- -
- 100%
- +
Urcelay, S. P. (2009). Veterinary epidemiology in Latin America. Preventive Veterinary Medicine, 92(4), 288-295.
Woolhouse, M. E. J. y Gowtage-Sequeria, S. (2005). Host range and emerging and reemerging pathogens. Emerging Infectious Diseases, 11(12), 1842-1847.

Patógenos en la interfaz ecosistema-humano-animal: fiebre aftosa en Sudáfrica
Viviana Marcela Méndez Mancera
Jorge Elías Tamayo Rozo
La fiebre aftosa es una enfermedad viral producida por un Aphtovirus de la familia Picornaviridae. Existen siete serotipos mundialmente reconocidos, de los cuales tres son endémicos en ciertas áreas de Sudáfrica. Esta fiebre es altamente contagiosa y afecta a todas las especies de biungulados. Se transmite por contacto directo entre los animales infectados y animales susceptibles. En algunos casos la infección se transmite por contacto indirecto como el ambiente, las personas, los vehículos, los animales silvestres o las aves (Dion, VanSchalkwyk y Lambin, 2011; Elnekave et al., 2016).
En el sur de África esta enfermedad es endémica. En esta región los búfalos africanos pueden estar persistentemente infectados con el virus, sin presentar signos clínicos de la enfermedad, y son generalmente responsables de los brotes en bovinos. Hay que mencionar que el contacto que existe entre estas especies silvestres y los animales domésticos se da básicamente en búsqueda de puntos de agua y áreas de pastoreo (Dion, VanSchalkwyk y Lambin, 2011; Jori y Etter, 2016). El contacto entre animales silvestres y domésticos es vital para la transmisión de enfermedades transfronterizas en ciertos lugares geográficos como el Parque Nacional Kruger (Sudáfrica) y sus provincias adyacentes (Brahmbhatt et al., 2012).
Por lo que se refiere a la epidemiología de la enfermedad, la principal fuente de fiebre aftosa es el riesgo que representan los rebaños de búfalos (Hargreaves et al., 2004; Elnekave et al., 2016). En estudios realizados en Sudáfrica se ha demostrado que el búfalo es capaz de mantener una infección silenciosa de los serotipos SAT-1, SAT-2 y SAT-3 durante mucho tiempo, independiente de la circulación de ganado (Vosloo y Thomson, 2004).
Interfaz de la enfermedad
Es importante destacar la transmisión de la enfermedad por contacto directo. Al existir este contacto entre búfalos y bovinos, ocasionado por la competencia en la búsqueda de puntos de agua para beber y praderas con mejores pasturas, se provoca un enlace directo, por características como movimientos, interacciones y comunicación en un ambiente común para satisfacer sus necesidades de alimentación. De esta forma se aumenta el riesgo de transmisión del virus de la fiebre aftosa (Dion, VanSchalkwyk y Lambin, 2011; Jori y Etter, 2016).
Dada la importancia de la transmisión del virus, cabe resaltar que una manada de búfalos puede estar permanentemente infectada sin desarrollar signos clínicos y actuar como reservorios para una futura transmisión del virus hasta por cinco años. De la misma manera, los terneros de búfalos desempeñan un papel importante en la dinámica de la enfermedad, ya que estos son los animales más infectados, y comienzan a ser susceptibles al virus de la fiebre aftosa en el periodo después de que decaen sus anticuerpos maternos y antes de desarrollar su inmunidad natural. Esto coincide con el lapso de los tres a los ocho meses de edad. De modo que la erradicación del virus es imposible sin la destrucción de un gran número de búfalos africanos. Por esta razón, es una solución ecológica y moralmente insostenible (Dion, VanSchalkwyk y Lambin, 2011; Jori y Etter, 2016).
Por otra parte, las mallas que separan el área de reserva donde se encuentran los búfalos son permeables. Como resultado directo o indirecto de los impactos físicos, o factores ecoclimáticos, estas mallas resultan averiadas, igualmente, por inundaciones, por erosión del suelo, por interferencia de otros animales, como los elefantes, o por acciones de las mismas personas, como es el caso de los cazadores furtivos, los recolectores de madera y las acciones de vandalismo. Esto incrementa el riesgo de transmisión por contacto directo con los bovinos domésticos (Dion, VanSchalkwyk y Lambin, 2011; Colenutt et al., 2016). Las mallas forman parte de los cordones sanitarios que se utilizan en Sudáfrica para separar los animales de vida silvestre de los domésticos, con el fin de prevenir la transmisión de enfermedades infecciosas. Dichas mallas son un método de control reconocido por la Organización Mundial de Sanidad Animal (Jori, et al., 2011; Emami et al., 2015).
Debido a factores ambientales como temperatura, humedad y precipitación, los animales modifican su comportamiento, de acuerdo con el ciclo de la biomasa y las redes hidrográficas, lo cual incrementa sus movimientos en periodos de deficiencias. En consecuencia, se presenta mayor contacto entre especies, lo que genera riesgo para la transmisión del virus (Dion, VanSchalkwyk y Lambin, 2011; Colenutt et al., 2016).
Las principales actividades de los pastores en el área de estudio son el cultivo y el pastoreo de ganado. Estos pastores locales están más preocupados por la disponibilidad de agua y pastos que por la fiebre aftosa (Dion, VanSchalkwyk y Lambin, 2011; Elnekave et al., 2016). Sin embargo, la presencia de asentamientos humanos cerca a los animales silvestres tiene un efecto repulsivo en los búfalos, lo que hace que estos se dispersen en grandes extensiones y traten de escapar (Dion y Lambin, 2012; Jori y Etter, 2016).
Con base en las características descritas de la interfaz humano-animal-ecosistema para la fiebre aftosa en este contexto, se infiere que es importante el entendimiento de la interacción entre cambios en el ecosistema y el clima, el uso del suelo, el comportamiento humano y la ecología del agente infeccioso en el hospedero. Así mismo, es imprescindible comprender que la distribución, la densidad, el comportamiento y las dinámicas poblacionales de los hospederos son particularmente controladas por las características del paisaje (Dion y Lambin, 2012; Berrian et al., 2016).
La cerrada interacción entre el ganado doméstico y la vida silvestre aumenta la probabilidad de transmisión de la enfermedad entre el ganado, la fauna y los seres humanos. Los brotes de enfermedades como la fiebre aftosa han causado graves trastornos a la persistencia de las especies silvestres, como el caso de la gacela de Mongolia (Procapra gutturosa). Todos los organismos nacionales de Mongolia comenzaron a culpar a las gacelas como la fuente de la transmisión de fiebre aftosa, lo cual llevó a decretar el sacrificio de todas ellas (Shiilegdamba et al., 2011; Berrian et al., 2016).
Condiciones ambientales en la interfaz que favorecen el mantenimiento y la dispersión del patógeno
Otro aspecto para plantear es que las temperaturas controlan la distribución diaria de los periodos de actividad de los búfalos. Estos pastan principalmente en la noche, tiempo en el que disminuye el periodo de calentamiento; en el día lo hacen durante los periodos fríos. Las condiciones climáticas pueden influir en el número de búfalos que escapan. Los contactos entre búfalos y el ganado también dependen de la sincronía entre sus actividades diarias y de su ubicación en cuanto a la disposición de alimentos (Dion y Lambin, 2012; Wieland et al., 2015).
Respecto al consumo de agua, los búfalos beben como mínimo una vez al día y se mueven hacia el punto de agua más cercano. Hay que mencionar, además, que el río Sabie bordea la valla del parque y es muy atractivo para beber; por lo tanto, favorece la presencia de los animales cerca de los límites del parque. Se infiere que si se añadieran puntos de agua en el interior del parque, los búfalos podrían mantenerse dentro de las instalaciones y así limitar su presencia contigua a la cerca; esto podría reducir el número de los búfalos que se escapan del parque (Dion y Lambin, 2012).
Sin embargo, otro de los aspectos es el crecimiento demográfico en los asentamientos humanos adyacentes al parque. Esto reduce las áreas de pastoreo disponibles y aumenta el número de bovinos que pueden estar en contacto con búfalos. Es probable que este crecimiento de asentamientos reduzca las zonas comunes reservadas para el pastoreo y desplace el ganado más cerca de la frontera con el parque, lo cual puede aumentar la probabilidad de contacto entre las dos especies. Si se considera el papel importante del ganado en los medios de subsistencia de los hogares rurales, el incremento de la población humana también podría estar asociado con un aumento de población de ganado (Jori y Etter, 2016).
Por otro lado, la quema controlada se utiliza ampliamente en las sabanas como manejo de la tierra, herramienta para aumentar la diversidad del paisaje. Por consiguiente, la quema controlada a lo largo de la frontera del parque hace que los búfalos escapen, ya que salen a buscar los corredores con vegetación de calidad. En consecuencia, una banda de vegetación quemada a lo largo de la valla podría romper la conexión entre la vegetación dentro y fuera del parque y así reducir el número de búfalos que escapan (Jori y Etter, 2016). Los factores que influyen en la dispersión de la fiebre aftosa se presentan en la figura 1.
FIGURA 1
DIAGRAMA DE LA TRÍADA ECOEPIDEMIOLÓGICA DE HOSPEDEROS Y RESERVORIOS DE LA ENFERMEDAD
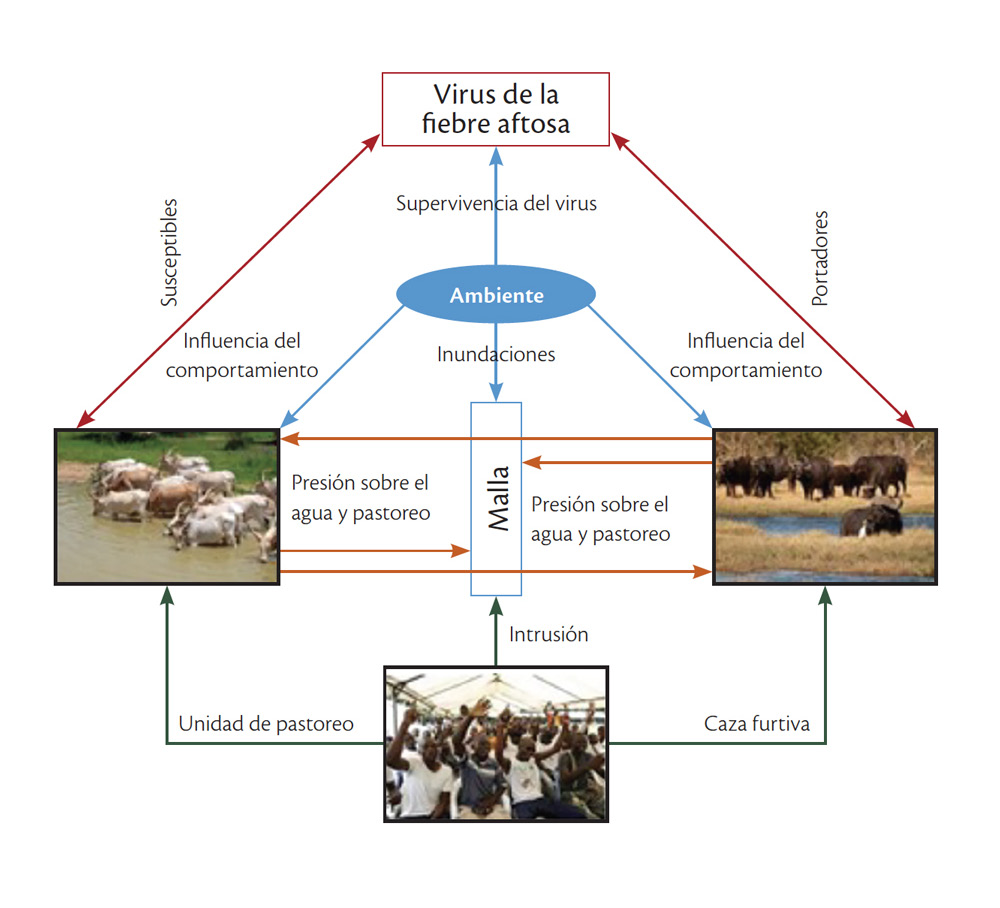
Fuente: elaboración propia.
Estrategias de prevención y control de la fiebre aftosa
A continuación se presentan algunas formas para prevenir y controlar la fiebre aftosa:
1. Principalmente el control de la fiebre aftosa se debe realizar sobre la base de la separación entre especies endémicas, como los búfalos, y especies susceptibles, como los bovinos.
2. Hay que realizar unas estrictas campañas de vacunación bianual contra fiebre aftosa.
3. Se deben utilizar animales centinelas para monitorear niveles de anticuerpos.
4. Se recomienda realizar inspección, vigilancia y control permanente a los animales susceptibles, lo cual debe estar a cargo de los médicos veterinarios.
5. Es imprescindible controlar la movilización de animales, especialmente los infectados, puesto que son el factor de riesgo más importante para la propagación de la fiebre aftosa. También es necesario tener en cuenta los productos derivados de las especies susceptibles.
6. Para la definición de los patrones epidemiológicos, se debe contar con el enfoque basado en los ecosistemas de áreas endémicas primarias (áreas de mantenimiento de virus), las zonas endémicas secundarias (áreas de la propagación de virus) y las zonas epidémicas (áreas de brotes explosivos) (Rweyemamu et al., 2008).
7. Vergne y colaboradores (2012) concluyeron que la situación de la fiebre aftosa en Camboya es altamente enzoótica, y los aldeanos no notifican los animales clínicamente afectados; por lo tanto, se debe llevar un subregistro de la enfermedad. Como punto clave para el control de la fiebre aftosa, es necesaria una notificación oportuna de esta por parte de las aldeas, las autoridades veterinarias y el sistema de vigilancia (Probert et al., 2016).
Referencias
Berrian, A. M., van Rooyen, J., Martínez-López, B., Knobel, D., Simpson, G. J., Wilkes, M. S. y Conrad, P. A. (2016). One Health profile of a community at the wildlife-domestic animal interface, Mpumalanga, South Africa. Preventive Veterinary Medicine, 130, 119-128.
Brahmbhatt D., Fosgate G., Dyason E., Budke C. y Gummow B. (2012). Contacts between domestic livestock and wildlife at the Kruger National Park Interface of the Republic of South Africa. Preventive Veterinary Medicine, 103, 16-21.
Colenutt, C., Gonzales, J. L., Paton, D. J., Gloster, J., Nelson, N. y Sanders, C. (2016). Aerosol transmission of foot-and-mouth disease virus Asia-1 under experimental conditions. Veterinary Microbiology, 189, 39-45.
Dion, E., VanSchalkwyk, L. y Lambin E. (2011). The landscape epidemiology of foot-and-mouth disease in South Africa: A spatially explicit multi-agent simulation. Ecological Modelling, 222(13), 2059-2072.
Dion, E. y Lambin, E. (2012). Scenarios of transmission risk of foot-and-mouth with climatic, social and landscape changes in southern Africa. Applied Geography, 35(1-2), 32-42.
Elnekave, E., van Maanen, K., Shilo, H., Gelman, B., Storm, N., Alhalq, M. A. y Klement, E. (2016). Prevalence and risk factors for foot and mouth disease infection in cattle in Israel. Preventive Veterinary Medicine, 130, 51-59.
Emami, J., Rasouli, N., McLaws, M. y Bartels, C. J. M. (2015). Risk factors for infection with foot-and-mouth disease virus in a cattle population vaccinated with a non-purified vaccine in Iran. Preventive Veterinary Medicine, 119(3), 114-122.
Hargreaves, S., Foggin C., Anderson E. A., Bastos D. y Thomson, G. (2004). An investigation into the source and spread of foot and mouth disease virus from a wildlife conservancy in Zimbabwe. Scientific and Technical Review of the Office International des Epizooties, 23(3), 783-790.
Jori, F., Brahmbhatt, D., Fosgateb, G., Thompson, P., Budke, C., Ward, M., et al. (2011). A questionnaire-based evaluation of the veterinary cordon fence separating wild life and livestock along the boundary of the Kruger National Park, South Africa. Preventive Veterinary Medicine, 100(3-4), 210-220.
Jori, F. y Etter, E. (2016). Transmission of foot and mouth disease at the wildlife/livestock interface of the Kruger National Park, South Africa: Can the risk be mitigated? Preventive Veterinary Medicine, 126, 19-29.
Probert, W. J., Shea, K., Fonnesbeck, C. J., Runge, M. C., Carpenter, T. E., Dürr, S. et al. (2016). Decision-making for foot-and-mouth disease control: Objectives matter. Epidemics, 15, 10-19.
Rweyemamu, M., Roeder, P., Mackay, D., Sumption, K., Brownlie, J., Leforban, Y. et al. (2008). Epidemiological patterns of foot-and-mouth disease worldwide. Transboundary and Emerging Diseases, 55(1), 57-72.
Shiilegdamba, E., Bolortsetseg, S., Fine, A. y Joly, D. (2011). Challenges managing foot and mouth disease at wildlife/livestock interface level on Mongolia’s Eastern Steppe. Recuperado de https://www.yumpu.com/en/document/view/51059568/challenges-managing-foot-and-mouth-disease-fmd-at-the-wildlife-
Vergne, T., Grosbois, V., Durand, B., Goutard, F. y Bellet, C. (2012). A capture-recapture analysis in a challenging environment: Assessing the epidemiological situation of foot-and-mouth disease in Cambodia. Preventive Veterinary Medicine, 105(3), 235-243.
Vosloo, W. y Thomson, G. (2004). Natural habitats in which foot-and-mouth disease viruses are maintained. En E. Domingo y F. Sobrino (Eds.), Foot-and-mouth disease: current perspectives (pp. 383-410). Londres: CRC Press.
Wieland, B., Batsukh, B., Enktuvshin, S., Odontsetseg, N. y Schuppers, M. (2015). Foot and mouth disease risk assessment in Mongolia-Local expertise to support national policy. Preventive Veterinary Medicine, 120(1), 115-123.
Encefalitis equina venezolana en la interfaz ecosistema-humano-animal
Maritza Rocío Lobatón Piñeros
“La encefalitis equina venezolana (EEV) es producida por el virus del mismo nombre [VEEV] (EEVV, muestra una distribución en casi todo el mundo y es miembro de la familia Togaviridae, género Alphavirus) el cual fue aislado en 1938” (Organización Panamericana de la Salud y Organización Mundial de la Salud, 2016). Este Alphavirus produce una infección que puede causar una variedad de enfermedades en humanos y animales, como caballos, mulas y burros, ganado caprino y bovino, perros y otros animales domésticos. Se transmite a los humanos por la inoculación del virus a través de la picadura de mosquitos hematófagos infectados ocasionalmente, y causa epizootias y epidemias, como se indica en la figura 1.
FIGURA 1
CICLOS DE TRANSMISIÓN ENZOÓTICA Y EPIZOÓTICA/EPIDÉMICA DEL VIRUS DE LA ENCEFALITIS EQUINA VENEZOLANA
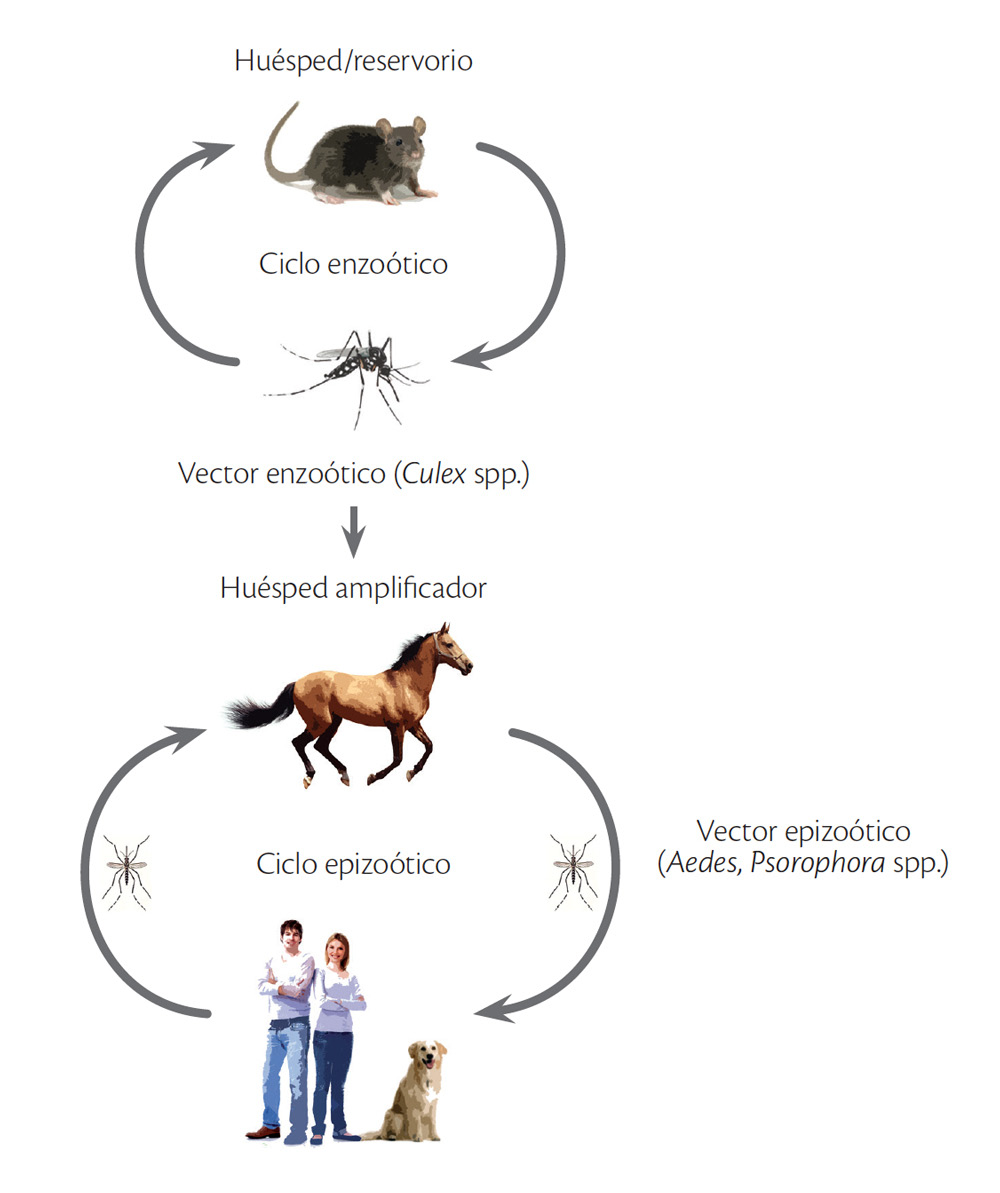
Fuente: Go, Balasuriya y Lee (2014).
La EEV es exclusiva del continente americano. Se distribuye principalmente en Centroamérica, Colombia, Ecuador, México, Perú, Trinidad y Venezuela (Medina et al., 2015). El virus de EEV está dividido en seis subtipos diferentes (Weaver y Barrett, 2004). Los subtipos que han generado largos brotes de la enfermedad en equinos son IAB e IC. El subtipo ID alcanzó una mutación en una parte de la glicoproteína del gen (E2). Esta mutación incrementó la habilidad de infectar al mosquito vector (Aedes taeniorhynchus) y la replicación en los equinos (Brault, Powers y Weaver, 2002; Ferro et al., 2014). El subtipo ID ha ocasionado brotes en Venezuela, Colombia, áreas del Amazonas, Ecuador y Perú (Estrada et al., 2004). Los subtipos ID e IE están dispersos en el norte de Florida y Argentina (Weaver y Barrett, 2004; Ferro et al., 2014).
En Colombia, la enfermedad fue documentada por primera vez en 1954. En ese lapso, los periodos entre epidemias oscilaron entre uno y diez años, pero a partir de 1973 su duración fue mayor. Desde 1995, cuando se presentó la última epidemia en el país, las cepas epizoóticas no se han vuelto a registrar, en tanto que sus progenitoras, las cepas enzoóticas, continúan circulando permanentemente en el territorio, por lo que el riesgo de reaparición de las cepas epizoóticas sigue vigente (Ferro et al., 2014). Es decir que la EEV y la encefalitis equina del este (EEE) continúan causando brotes en équidos (caballares, mulares y asnales), lo cual, a su vez, pone en riesgo a poblaciones humanas, debido a que existen zonas de mayor riesgo de presentación de la enfermedad, teniendo en cuenta la circulación del vector y las condiciones geográficas ubicadas en altitudes menores de los 1200 m s. n. m. que favorecen su proliferación. De acuerdo con la información recolectada a través del sistema de vigilancia epidemiológica veterinaria del Instituto Colombiano Agropecuario (ICA), para 2014 se confirmaron nueve casos positivos a EEV en los departamentos de Vichada (1), Norte de Santander (1), Magdalena (2), Chocó (1), Cesar (1), Cauca (2) y Bolívar (1) (ICA, 2016).
En diferentes partes del mundo, la EEV es tema de alerta sanitaria y vigilancia epidemiológica, ya que la infección humana se presenta con síntomas similares a la gripe, pero puede conducir a la encefalitis e incluso a la muerte. La tasa de mortalidad en los brotes humanos oscila entre 1 % para VEEV y 3 a 7 % para encefalitis equina del oeste (VEEO). Las tasas de mortalidad han registrado brotes en equinos con 20-80 % de VEEV, lo cual representa una importante amenaza para la salud pública y veterinaria (Campos-Gómez et al., 2016). Se han realizado varios estudios en los que se analizan los diferentes componentes del ciclo biológico, para determinar cuál es la dinámica de cada elemento dentro de los ecosistemas y los factores de riesgo de la enfermedad.
Contexto de la interfaz ecosistema-humano-animal de encefalitis equina venezolana
La vida humana depende de la dinámica del sistema climático de la tierra y las interacciones entre la atmósfera, los océanos, la biosfera terrestre y marina, la criosfera y la superficie terrestre, lo cual determina el clima de la superficie del planeta. La concentración atmosférica de los gases de efecto invernadero se incrementa debido principalmente a la actividad humana, lo que provoca un recalentamiento de la superficie terrestre. Se estima que la temperatura mundial habrá aumentado como promedio 1,0 a 3,5 °C para 2100, con lo que aumentará también el riesgo de enfermedades transmitidas por vectores (Aguirre, 2000). En este sentido, el mayor efecto del cambio climático se observará probablemente en los extremos del intervalo de temperaturas requerido para la transmisión (14-18 °C como límite inferior, y 35-40 ºC como límite superior) (Githeko et al., 2000; Khan, 2016).
En América del Sur, el paludismo, la leishmaniasis, el dengue, la enfermedad de Chagas y la esquistosomiasis son las principales enfermedades de transmisión vectorial favorecidas por las condiciones climáticas. Otras son la fiebre amarilla, la peste, la EEV y varias enfermedades arbovirales detectadas en la región amazónica, por ejemplo, la fiebre de Oropouche. Como consecuencia de la sequía provocada por el fenómeno de El Niño (Lundstrom 1999; Khan, 2016), el VEEV sobrevive de acuerdo con la región donde se presente el vector competente (Culex Melanoconion) y un huésped vertebrado, como algunas especies de pájaros y roedores (Vittor et al., 2016)
Así mismo, el ciclo silvestre está limitado por la distribución geográfica; se puede encontrar en humedales y en bosques tropicales (Aguilar et al., 2011). En contraste con lo anterior, en el ciclo urbano el virus es trasmitido por el vector (Aedes y Psorophora spp.) abundante en hábitats agrícolas y por la alta presencia de los huéspedes (équidos) (Weaver et al., 1999; Vittor et al., 2016). Por otra parte, no solo humanos y equinos desarrollan la infección, sino también perros, cerdos, vacas, gatos, ovejas, murciélagos y algunas aves (Krauss et al., 2003; Medina et al., 2015).
Aproximadamente 150 especies animales pueden ser infectadas por EEV en condiciones naturales. Los equinos son la especie más afectada. El 50 % de los casos desarrollan encefalitis; también puede desarrollarse en perros y cerdos. Los casos clínicos en perros pueden ser mortales (Khan, 2016).
A través de la Resolución 1026 de 1999 se establecen medidas sanitarias para la prevención y control de la EEV. El ente encargado del control y la prevención de la enfermedad en Colombia es el ICA. En Colombia existe la vacuna para equinos, elaborada por el laboratorio farmacéutico Vecol, y es distribuida en territorio nacional por el ICA. Está elaborada a base de virus atenuado de la EEV de la cepa TC83, liofilizada.
A su vez, la vigilancia de la enfermedad se realiza por medio del sistema de información y vigilancia epidemiológica de las encefalitis equinas en Colombia, realizado por el Instituto Nacional de Salud, el Ministerio de Agricultura y Desarrollo Rural, el ICA y el Ministerio de Ambiente y Desarrollo Sostenible. Mediante estos sistemas se vigilan seis aspectos que son: ecología local, dinámica estacional y monitoreo de datos meteorológicos, vigilancia de los huéspedes vertebrados, vigilancia de los casos en equinos, en aves y en humanos (ICA, 2004).
Factores predisponentes en la interfaz
La presentación de estos casos en zonas tropicales se debe a que la mayoría de las personas infectadas residen dentro de los límites de la ciudad y su ocupación (forestación nocturna) contribuye con la presentación de los casos positivos, dado que los mosquitos vectores (Culex [Melanoconion]) son crepusculares, y por lo tanto tendrían acceso a las personas durante las horas de la oscuridad (Aguilar et al., 2004). Morrison y colaboradores (2008) realizaron un estudio del VEEV de transmisión urbana de una cepa selvática en Perú. Se evidenció que los estudios de este tipo se realizaban en zonas rurales o selváticas, nunca en zonas urbanas. Se puede inferir que la relación entre el crecimiento y la expansión de poblaciones hacia zonas periurbanas, donde hay bastante cercanía con bosques, hábitat de roedores y mosquitos, concuerda con la presentación de la enfermedad. Además de los climáticos cíclicos, el aumento en el caudal de los ríos incrementa el número de vectores competentes dentro de la ciudad. Los casos de EEV se encuentran vinculados con la invasión humana en las zonas forestales, debido a actividades como la agricultura y la explotación forestal que aumentan el contacto con los vectores del virus.
Conclusiones
A lo largo de este capítulo se puede evidenciar que el calentamiento global y la alteración de la atmósfera están relacionados en la habilidad del vector del VEEV para adaptarse, multiplicarse y tener más posibilidades de contacto con el huésped, ya que son organismos capaces de resistir y adaptarse a cualquier medio. La invasión de los humanos a los bosques y humedales y el aumento de las producciones agropecuarias hacen que se incremente el número de casos positivos en humanos y equinos (Vittor et al., 2016).


