- -
- 100%
- +
Al entender el comportamiento y la dinámica del agente etiológico, los posibles vectores, los huéspedes y la relación que existe entre ellos, de cualquier enfermedad zoonótica o infecciosa, se pueden establecer política públicas, claras, precisas, más ajustadas a la realidad y al medio en que estamos inmersos, que involucren a todos (médicos veterinarios, médicos de humanos, biólogos, ecologistas y la comunidad en general). Con esto se podrá ejercer verdadero control y prevención de las enfermedades de interés en salud pública.
Referencias
Aguilar, P. V., Greene, I. P., Coffey, L. L., Medina, G., Moncayo, A. C., Anishchenko, M. y Tesh, R. B. (2004). Endemic Venezuelan equine encephalitis in northern Peru. Emerging Infectious Diseases, 10(5), 880-888.
Aguirre, M. (2000). Defensa y recursos: el debate sobre la seguridad en la globalización. Nação e Defesa, (95-96), 93-111.
Brault, A. C., Powers, A. M. y Weaver, S. C. (2002). Vector infection determinants of Venezuelan equine encephalitis virus reside within the E2 envelope glycoprotein. Journal of Virology, 76(12), 6387-6392.
Campos-Gómez, J., Ahmad, F., Rodríguez, E. y Saeed, M. F. (2016). A novel cell-based assay to measure activity of Venezuelan equine encephalitis virus nsP2 protease. Virology, 496, 77-89.
Estrada-Franco, J. G., Navarro-Lopez, R., Freier, J. E., Cordova, D., Clements, T., Moncayo, A., et al. (2004). Venezuelan equine encephalitis virus, southern Mexico. Emerging Infectious Diseases, 10(12), 2113-2121.
Ferro, C., Boshell, J., Moncayo, A. C., González, M., Ahumada, M. L., Kang, W. y Weaver, S. C. (2003). Natural enzootic vectors of Venezuelan equine encephalitis virus, Magdalena Valley, Colombia. Emerging Infectious Diseases, 9(1), 49-54.
Ferro, C., De las Salas, J., González, M., Díaz, A., Cabrera, C., Flórez, Z. y Bello, B. (2014). ¿Existen condiciones que favorecen la reaparición del virus de la encefalitis equina venezolana en la Alta Guajira colombiana? Biomédica, 35(1), 62-72.
Githeko, A. K., Lindsay, S. W., Confalonieri, U. E. y Patz, J. A. (2000). Climate change and vector-borne diseases: a regional analysis. Bulletin of the World Health Organization, 78(9), 1136-1147.
Go, Y. Y., Balasuriya, U. B. y Lee, C. K. (2014). Zoonotic encephalitides caused by arboviruses: transmission and epidemiology of alphaviruses and flaviviruses. Clinical and Experimental Vaccine Research, 3(1), 58-77.
Instituto Colombiano Agropecuario. (2016). Informe especial: encefalitis equina venezolana. ICA Comunica. Recuperado de http://www.ica.gov.co/Periodico-Virtual/Prensa/Informe-especial-Encefalitis-Equina-Venezolana.aspx
Instituto Colombiano Agropecuario, Instituto Nacional de Salud, Ministerio de Ambiente, Vivienda y Desarrollo Rural. (2004). Sistema de información y vigilancia epidemiológica de las encefalitis equinas en Colombia (encefalitis equina venezolana, encefalitis equina del este, encefalitis equina del oeste, encefalitis equina del Nilo occidental). Recuperado de http://www.ica.gov.co/getdoc/21d60c2f-b469-4812-98d7-d6559b689a5e/SISTEMA-vigilancia-epidemiologica-ICA.aspx
Khan, M. A. (2016). Important vector-borne diseases with their zoonotic potential: Present situation and future perspective. Bangladesh Journal of Veterinary Medicine, 13(2), 1-14.
Krauss H., Weber, A., Appel, M., Enders, B., Isenberg, H. y Schiefer H. (2003). Zoonoses, infectious diseases transmissible from animals to humans. 3a. ed. Washington, DC: ASM Press.
Lundström, J. O. (1999). Mosquito-borne viruses in western Europe: a review. Journal of the Society for Vector Ecology, 24(1), 1-39.
Medina, G., Garzaro, D. J., Barrios, M., Auguste, A. J., Weaver, S. C. y Pujol, F. H. (2015). Genetic diversity of Venezuelan alphaviruses and circulation of a Venezuelan equine encephalitis virus subtype IAB strain during an interepizootic period. The American Journal of Tropical Medicine and Hygiene, 93(1), 7-10.
Morrison, A. C., Forshey, B. M., Notyce, D., Astete, H., López, V., Rocha, C. y Kochel, T. J. (2008). Venezuelan equine encephalitis virus in Iquitos, Peru: urban transmission of a sylvatic strain. PLoS Neglected Tropical Diseases, 2(12), e349.
Organización Panamericana de la Salud y Organización Mundial de la Salud. (2016). Encefalitis equina venezolana. Recuperado de http://www.paho.org/hq/index.php?option=com_content&view=article&id=8300%3A2013-encefalitis-equina-venezolana&catid=908%3Aviral-diseases-home&Itemid=39851&lang=es
Vittor, A. Y., Armien, B., González, P., Carrera, J. P., Domínguez, C., Valderrama, A. y Castillo, A. (2016). Epidemiology of emergent Madariaga encephalitis in a Region with endemic Venezuelan equine encephalitis: initial host studies and human cross-sectional study in Darien, Panama. PLoS Neglected Tropical Diseases, 10(4), e0004554.
Weaver, S. C. y Barrett, A. D. (2004). Transmission cycles, host range, evolution and emergence of arbovirala disease. Nature Reviews Microbiology, 2(10), 789-801.
Weaver, S. C., Powers, A. M., Brault, A. C. y Barrett, A. D. (1999). Molecular epidemiological studies of veterinary arboviral encephalitides. The Veterinary Journal, 157(2), 123-138.
Dengue como modelo de interfaz ecosistema-humano-animal
Ana Isabel Celly Trujillo
Las enfermedades transmitidas por vectores constituyen un problema en el ámbito global, debido a la propagación e introducción de enfermedades emergentes y reemergentes en nuevos continentes. Para el caso del dengue, un arbovirus RNA, se transmite por la picadura de mosquitos del género Aedes aegypti y Aedes albopictus, siendo este el vector principal. El virus pertenece a la familia Flaviviridae, la cual presenta cuatro variantes, los serotipos DEN-1, DEN-2, DEN-3 y DEN-4. La inmunidad es serotipo-específica, por lo que la infección con un serotipo determinado otorga inmunidad permanente contra este, aunque su duración es por unos meses. Hay teorías que sugieren que una persona podría padecer de dengue hasta cuatro veces a lo largo de su vida, una vez por cada serotipo. Sin embargo, solo se han comprobado hasta tres infecciones en un mismo individuo (Ministerio de Salud de Argentina, 2013; Imai et al., 2016).
La epidemia del virus del dengue es considerada una de las más antiguas en la historia y se caracteriza por presentar brotes en periodos infrecuentes. No obstante, el virus, incluidos sus cuatro serotipos, ha mostrado una reemergencia con alta actividad en zonas tropicales. Cabe señalar que los factores que favorecen la presencia de esta enfermedad son: la expansión geográfica del mosquito vector y del virus, la evolución y adaptación del patógeno a nuevas zonas, la emergencia de la fiebre hemorrágica del dengue y el cambio climático (Gubler, 1997; Suwanbamrung et al., 2013).
Se estima que alrededor de 2,5 billones de personas, la mayoría residentes de grandes y pequeñas ciudades del trópico y subtrópico, están en continuo riesgo de padecer la enfermedad. Actualmente se considera a más de 100 países como endémicos para el dengue y dengue hemorrágico. Un total de 50 a 100 millones de nuevos casos de infección por dengue han sido registrados, mientras se estiman 500.000 casos por dengue hemorrágico; hasta el momento se ha estimado este número. No obstante, cabe resaltar que la vigilancia epidemiológica es débil en la mayoría de las ciudades (Organización Mundial de la Salud [OMS], 2013).
El panorama en Latinoamérica durante 2010 registró brotes de dengue en varios países con un número total de casos que han superado los datos históricos anteriores. Fueron notificados más de 1,6 millones de casos, de los cuales 49.000 correspondían a dengue grave; más de 1000 personas fallecieron. Los países que registraron brotes fueron Brasil, Bolivia, Colombia, Guatemala, Nicaragua, México, Honduras, Puerto Rico, Perú, Venezuela y República Dominicana, entre otros (Dayan et al., 2015).
En los años noventa en Colombia se presentaban en promedio 30.000 registros cada año. En la última década el número se aumentó a 50.000. De esta cifra, el 76,1 % de los casos procede de diez entidades territoriales, que incluyen Santander, Norte de Santander, Cundinamarca, Meta, Cesar, Tolima, Huila, Valle, Putumayo y Antioquia (Instituto Nacional de Salud [INS], 2014).
El dengue es la arbovirosis humana que causa mayor morbilidad, mortalidad y afección económica en las regiones tropicales y subtropicales del mundo. El abordaje del paciente con diagnóstico probable de dengue tiene como objetivo identificar la fase clínica de la enfermedad en la que se encuentra, con el fin de instaurar un plan terapéutico adecuado. La primera manifestación clínica es fiebre de variable intensidad; se asocia a cefaleas, dolor retroocular, mialgias y artralgias. En niños se pueden evidenciar cuadros de fiebre junto con síntomas digestivos inespecíficos. El eritema faríngeo puede estar presente en algunos casos, así como signos respiratorios, aunque no son frecuentes (Malagón, Padilla y Rojas Álvarez, 2011; Bowman et al., 2016).
Es una enfermedad de alto impacto en salud pública y en lo económico. Presenta reemergencia y comportamiento epidemiológico cada dos o tres años. En esta instancia, Colombia se considera un país endémico para el dengue, en cuya problemática hay que tener presente factores como el cambio climático. La estrecha cercanía que hay entre el vector y las personas hace necesario ver desde diferentes visiones la enfermedad. Con esto se busca conocer la interfaz que hay entre ecosistema-humano-animal para generar futuras medidas de intervención y control para esta problemática (Rodríguez-Salazar et al., 2016).
Concepto de las interfaces del dengue
El concepto de transiciones epidemiológicas es importante para describir la evolución del virus del dengue. Este surge a partir de la perturbación ecológica presentada en el sureste de Asia durante y después de la segunda guerra mundial, cuando los sistemas de agua fueron destruidos, lo cual obligó a almacenarla para el uso doméstico y para el control de incendios. El agua se recolectaba de la lluvia sin considerar algún tratamiento previo o sin tener la precaución de tapar los recipientes donde se almacenaba. Esto llevó al crecimiento de hábitats larvarios ideales para el mosquito Aedes aegypti. Después de la recolecta, se trasladaban los recipientes a diversas ciudades y países, llevando consigo mosquitos y sus huevos a nuevas áreas geográficas. Por lo anterior se incrementó la densidad poblacional del mosquito, su adaptación a nuevos lugares; se facilitó la movilidad de soldados infectados con el virus, lo cual aumentó el número de individuos susceptibles en zonas no endémicas de la enfermedad. La guerra, se puede decir, es la responsable de crear alta densidad de mosquitos y de transportar el virus tanto al sudeste asiático como al Pacífico (Maneerat y Daudé, 2016).
En ese sentido, la movilización de poblaciones, el desplazamiento forzado, el deterioro de los sistemas de alcantarillado, la urbanización y los desastres dejados por la segunda guerra mundial fueron factores importantes en el incremento de la frecuencia de transmisión del dengue. Se evidenciaron grandes epidemias en las que los grupos etarios de niños y la población indigente fueron los más afectados. La rápida aparición de nuevos serotipos del virus y la propagación de la enfermedad a nuevas zonas fueron factores que mostraron una gran interacción con las condiciones ambientales y climáticas, lo que llevó a que se estableciera la presencia del vector y el consiguiente contacto con las personas y las actividades que desempeñan las diferentes poblaciones. Estos hechos contribuyen a la presentación de la enfermedad (Gubler, 1997; Maneerat y Daudé, 2016).
Dengue como modelo de interfaz
El transporte de animales por diferentes medios de movilización (barcos y aviones, por ejemplo) ha permitido introducir diferentes especies de vectores a nuevas zonas geográficas, como en el caso del dengue. Se especula que el mosquito Aedes aegypti se llevó por medio de un avión jumbo sin que nadie tuviera conocimiento de este, lo cual provocó importantes brotes de dengue intercontinentales al pasar el mosquito adulto o sus huevos inadvertidos, mientras el objetivo principal era el de transportar únicamente animales domésticos (Greger, 2007; Cook, 2005).
Los cambios evidenciados en el clima han permitido un aumento y variabilidad en la distribución de las enfermedades tropicales como la malaria y el dengue. Las alteraciones en las tasas de precipitación, con el incremento de la erosión y de los niveles del mar, obligan a las especies a evolucionar paulatinamente y adaptarse a estas variaciones. Los animales y el hombre no son los únicos afectados de forma directa; también los vectores como las garrapatas y mosquitos deben atravesar por las alteraciones ambientales, lo que origina cambios genéticos y moleculares para llegar adaptarse y poder así sobrevivir e impedir la extinción de la especie.
Efectos como el cambio climático, la adaptación de los vectores, la susceptibilidad del huésped, los cambios en los ecosistemas, el crecimiento poblacional, la globalización y las mutaciones virales son parte esencial en la presentación de enfermedades emergentes. En el caso del dengue, estos factores contribuyen para volverlo un patógeno endémico casi a nivel mundial (King, 2004; Naish et al., 2014).
El conocimiento de la ecología evolutiva y la biología, asociadas a la biodiversidad genética, puede proveer antecedentes sobre los ciclos de vida, la asociación con huéspedes, el desarrollo de inmunidad, los mecanismos de infección, entre otros. Las interacciones o interfaces humano-animal-ecosistema son importantes en la aparición de enfermedades emergentes, reemergentes y zoonóticas tanto en el ámbito histórico como en el actual (San Martín, 2011; Morin, Comrie y Ernst, 2013) (figura 1).
FIGURA 1
MODELO DE INTERFAZ HUMANO-ANIMAL-MICROBIO-SILVESTRE CON LOS DIFERENTES FACTORES POTENCIALES
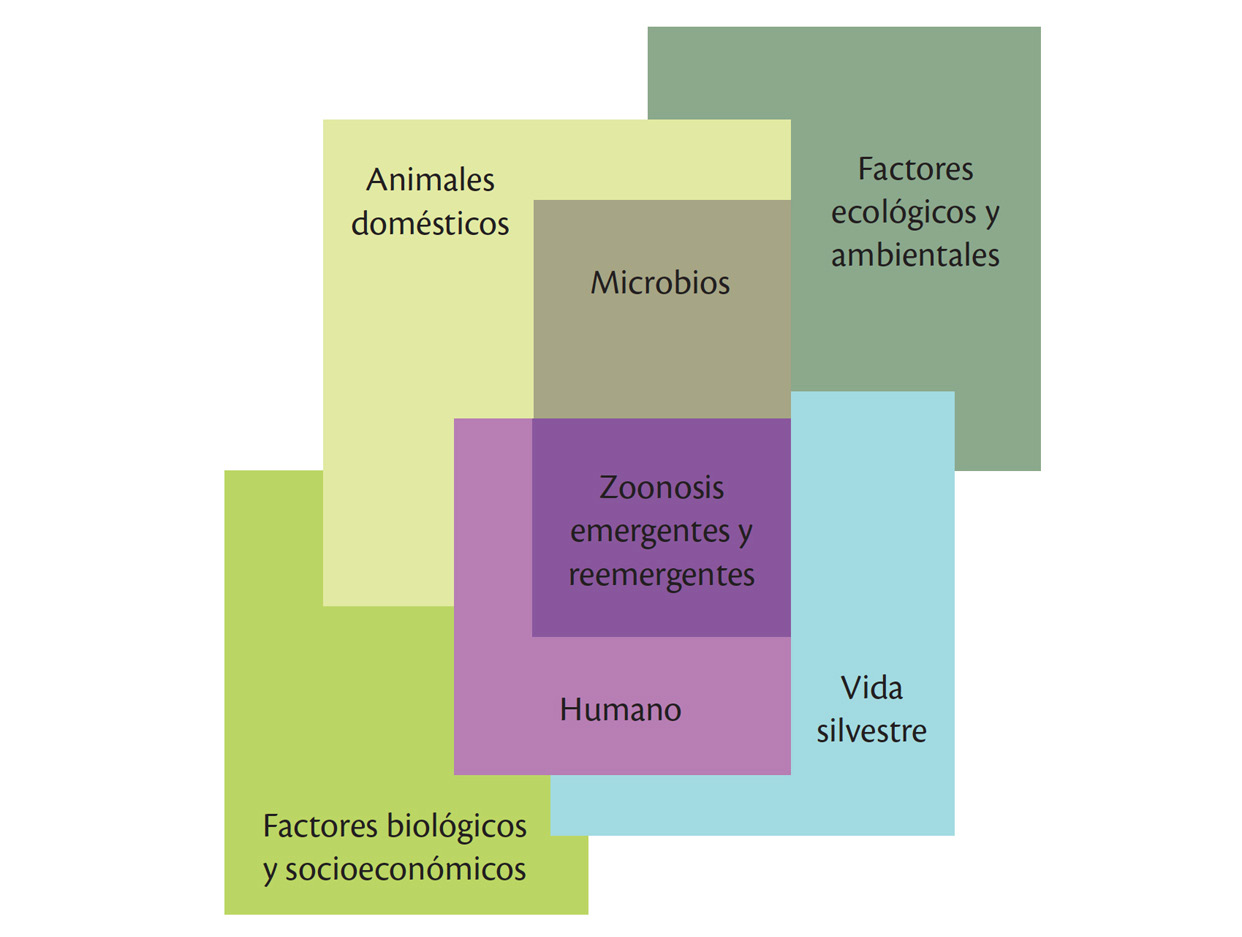
Fuente: King (2004).
Huéspedes, reservorios y vectores del dengue
Según la OMS (2014), se considera a los primates no humanos como los huéspedes y reservorios del virus del dengue en África y en el sureste asiático. Hay registros de animales domésticos y silvestres que sugieren las vacas, los perros, los murciélagos y las ovejas como posibles reservorios del virus; sin embargo, continúan los estudios para confirmar este supuesto (Schaffner y Mathis, 2014).
Se considera al humano como un reservorio natural del virus del dengue, el cual desempeña un rol crítico en la propagación de la enfermedad a nuevas regiones geográficas (figura 2). Si un humano se encuentra infectado por el virus, al viajar a un lugar donde el vector esté presente hay posibilidades de contacto, lo cual permite la propagación de la enfermedad a nuevas áreas (Bain, 2011; Kakumani et al., 2016).
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.


