- -
- 100%
- +
Die Diagnostik erfolgt mittels biochemischen Nachweises spezifischer Enzymdefekte. Bei Diagnose einer rasch verlaufenden Parodontitis ist insbesondere eine Differenzialdiagnose zwischen Typ IV und VIII wichtig, weil Typ IV wegen der viszeralen und Gefäßrupturen eine ungünstigere Prognose hat13.
Weitere Erkrankungen
Langerhans-Zell-Histiozytose
Die Langerhans-Zell-Histiozytose (LZH; Histiozytose-Syndrom; ORPHA389/ICD-10: C96.6) bezeichnet die abnormale Ansammlung oder Proliferation von Zellen des Langerhans-Zellphänotyps zusammen mit Entzündungszellen (eosinophile und neutrophile Granulozyten, Lymphozyten und Mastzellen) in verschiedenen Regionen und Organen, die das Gewebe infiltrierend zerstören. Die Inzidenz wird auf 2 bis 5 Fälle pro Million Einwohner pro Jahr geschätzt. Symptome und Prognose der LZH hängen von der Zahl der Läsionen und den befallenen Organen ab. Die Verlaufsformen reichen von der bei Neugeborenen auftretenden schweren und lebensbedrohlichen akut disseminierenden LZH (Morbus Letterer-Siwe) über ein breites Spektrum von Kombinationen von Symptomen (Diabetes insipidus, Exophtalmus, skelettale Läsionen; chronisch diffuse LZH: Morbus Hand-Schüller-Christian) bis zur rein Haut und Schleimhäute betreffenden kongenitalen Retikulohistiocytosis mit dunklen Knötchen am Stamm, im Gesicht und auf der Kopfhaut ohne Beteiligung anderer Organe (Hashimoto-Pritzker-Syndrom) bzw. solitären Knochenläsionen, die häufiger im Erwachsenenalter auftreten (chronisch fokale LZH: eosinophiles Granulom)14.
Die Ätiologie ist unklar, möglicherweise entsteht die LZH durch eine hypersensitive Reaktion auf ein unbekanntes Antigen, die das Histiozyten-Makrophagen-System stimuliert, oder es handelt sich um eine Autoimmunkrankheit14.
Läsionen können auch intraoral auftreten und klinisch das Erscheinungsbild einer rasch verlaufenden oder nekrotisierenden Parodontitis annehmen14 (Abb. 3a und b).
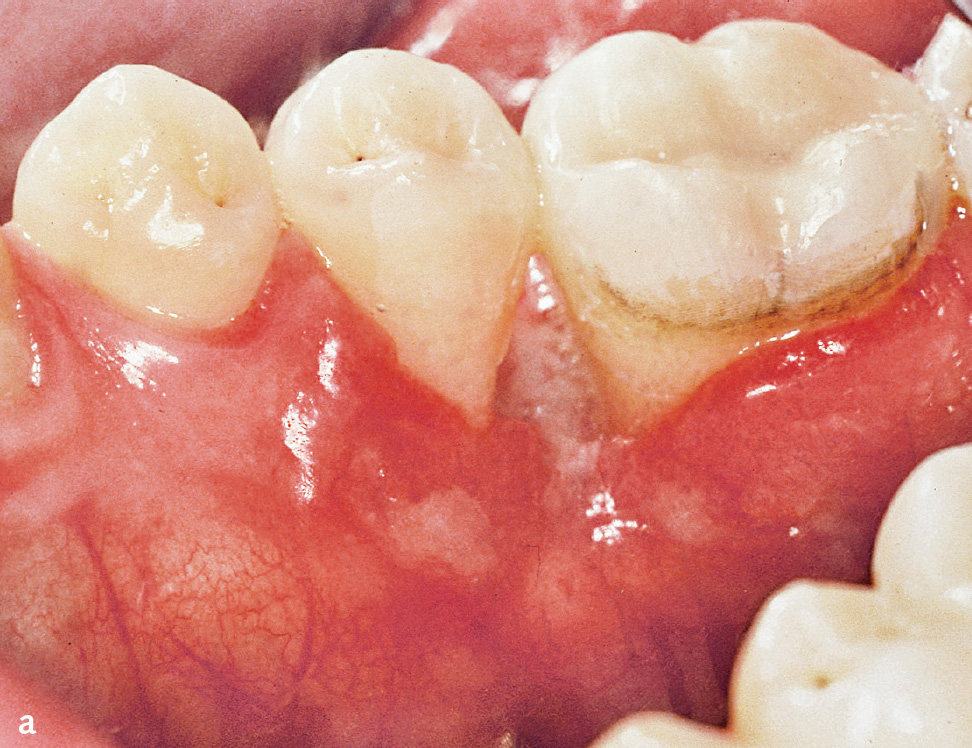
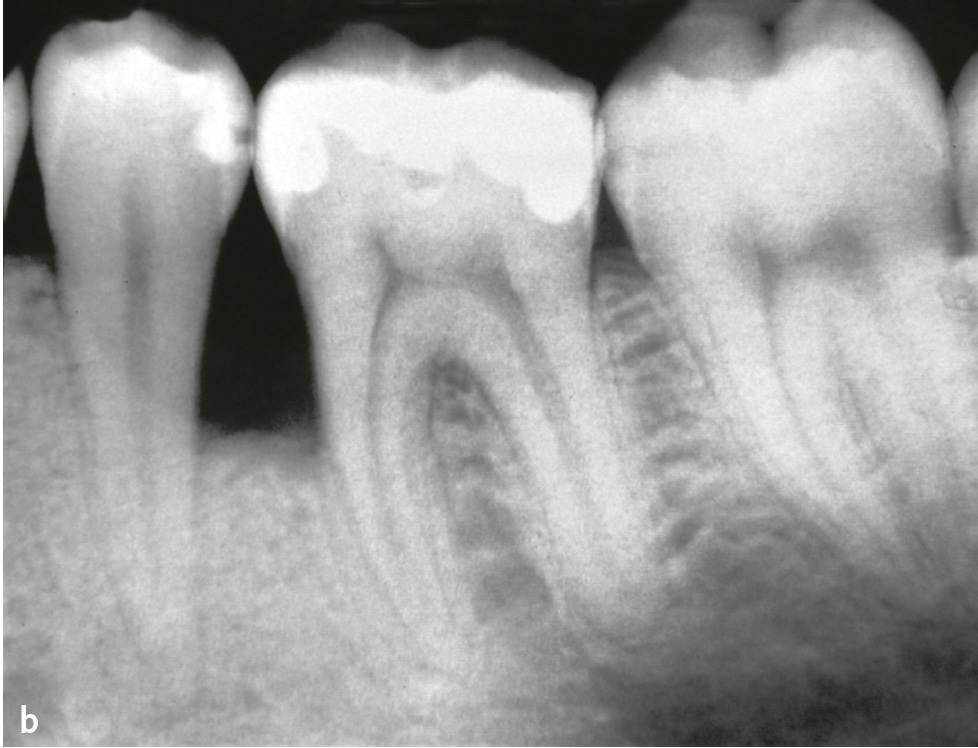
Abb. 3a und b 24-jähriger männlicher Patient mit oralen Manifestationen einer Langerhans-Zell-Histiozytose (eosinophiles Granulom) approximal der Zähne 35 und 36: a) klinische Ansicht; b) Röntgenbild mit approximalem Knochenabbau (Abbildungen aus Kugel et al. 20015).
Die Diagnose wird histologisch, immunhistochemisch (positive Marker für S-100 und/oder CD1A) und elektronenmikroskopisch (BirbeckGranula in Langerhans-Zellen) gesichert. Die Prognose der LZH ist schwierig zu stellen, da die Erkrankung selten vorkommt und sehr unterschiedliche Krankheitsverläufe beobachtet werden. Die Beteiligung innerer Organe führt zu einer schlechten Prognose. Je jünger der Patient, desto schlechter die Prognose. An der Prognose orientiert sich die Therapie. Bei den meisten Patienten tritt eine Selbstlimitation auf. Es gibt aber unvorhersehbare Rezidive. Lokale orale, parodontale Läsionen werden chirurgisch ausgeräumt. Die Therapie anderer Läsionen liegt in den Händen des Internisten oder Dermatologen14.
Trisomie 21
Die Trisomie 21 (Down-Syndrom, Morbus Langdon-Down, numerische autosomale Chromosomenaberration; ICD-10: Q90.9) ist die häufigste chromosomale Abweichung beim Menschen. Es liegt eine komplette oder partielle Trisomie von Chromosom 21 in allen oder einigen Zellen des Organismus vor. Die Inzidenz liegt in Norwegen bei 1,1 von 1.000 Lebendgeburten. Die Trisomie 21 geht mit geistiger Retardierung, angeborenen Herzfehlern, gastrointestinalen Fehlbildungen, reduziertem neuromuskulären Tonus, charakteristischen Veränderungen im Kopf-Hals-Bereich und der Atemwege einher. Die Lebenserwartung von Patienten mit Trisomie 21 hat sich von 35 Jahren in 1982 auf heutzutage etwa 60 Jahre verlängert15.
Das klinische Bild zeigt meist eine erhebliche, aber individuell verschieden entwicklungsfähige geistige Behinderung und eine unterschiedlich ausgeprägte, typische Dysmorphie. Im Kopfbereich imponieren eine Brachyzephalie, Mikrozephalie, lateral-kranial ansteigende Lidachsen, Epikanthus, Hypertelorismus, eine breite Nasenwurzel, tiefsitzende Ohren, eine Unterentwicklung der Kiefer und Zähne (Hypodontie), ein meist offener Mund, vermehrte Speichelsekretion und eine große gefurchte Zunge. Bei Patienten mit Trisomie 21 zeigen sich bereits im Milchgebiss einsetzende Parodontitiden unterschiedlicher Progression. Es konnte gezeigt werden, dass Patienten mit Trisomie 21 stärkere parodontale Destruktionen aufweisen als vergleichbare, auch vergleichbar mental eingeschränkte, Kontrollgruppen. Es kann bei Trisomie 21 also von einer genetischen Prädisposition ausgegangen werden, der funktionale Defekte der PMNs und Monozyten sowie Veränderungen des Kollagenstoffwechsels und eine abweichende Morphologie der Kapillaren zugrunde liegen13.
Die Diagnose wird durch den typischen Phänotyp bereits bei der Geburt oder durch pränatale Amniozentese oder Chorionzottenbiopsie gestellt bzw. gesichert. Bei gezielter, frühzeitig begonnener und individuell angepasster Förderung sind Kinder mit Down-Syndrom lernfähig und sozial gut integrierbar. Sie können eine gewisse Selbstständigkeit erwerben. Der entscheidende Faktor für eine Prävention und Therapie parodontaler Erkrankungen ist die Toleranz gegenüber zahnärztlicher Betreuung. Halbjährliche zahnärztliche Kontrollen werden empfohlen14.
Fazit
Die dargestellten Erkrankungen sind sehr selten bzw. kaum zu beobachten, die meisten gehören zur Gruppe der seltenen Erkrankungen. Die Wahrscheinlichkeit, dass sich ein davon betroffener Patient vorstellt, ist sehr gering. Dennoch sollte man die Erkrankungsbilder im Hinterkopf haben und bei vorzeitigem Zahnverlust oder bei im Milchgebiss beginnender Parodontitis an sie denken. Der parodontale Befund kann so zur frühzeitigen Diagnose der Grunderkrankung führen oder Anlass zu frühzeitig einsetzender parodontaler Therapie sein mit dem Ziel, den Patienten die natürlichen Zähne möglichst lange zu erhalten.
Literatur
1. Caton JC, Armitage G, Berglundh T et al. A new classification scheme for periodontal and peri-implant diseases and conditions – Introduction and key changes from the 1999 classification. J Clin Periodontol 2018;45 (Suppl 20):S1–S8.
2. Eickholz P, Nickles K. Glossar der Grundbegriffe für die Praxis. Klassifikation der parodontalen und periimplantären Erkrankungen und Zustände. Parodontologie 2019;30:65–77 (s. Beitrag 9 in diesem Buch).
3. http://www.orpha.net/consor/cgi-bin/index.php?; letzter Zugriff am 23.11.2020.
4. Harris ES, Weyrich AS, Zimmerman GA. Lessons from rare maladies: leukocyte adhesion deficiency syndromes. Curr Opin Hematol 2013;20:16–25.
5. Kugel B, Klein F, Eickholz P. Glossar der Grundbegriffe für die Praxis: Parodontitis als Symptom von Syndromerkrankungen. Parodontologie 2001;12:301–308.
6. Noack B, Görgens H, Hoffmann T, Fanghänel J, Kocher T, Eickholz P, Schackert HK. Novel mutations in the cathepsin C gene in patients with pre-pubertal aggressive periodontitis and Papillon-Lefevre syndrome. J Dent Res 2004;83: 368–370.
7. Nickles K, Schacher B, Ratka-Krüger P, Krebs M, Eickholz P. Long-term results after treatment of periodontitis in patients with Papillon–Lefèvre syndrome: success and failure. J Clin Periodontol 2013;40:789–798.
8. Pahwa P, Lamba, AK, Faraz F, Tandon S. Haim-Munk syndrome. J Indian Soc Periodontol 2010;14:201–203.
9. Hajishengallis E, Hajishengallis G. Neutrophil homeostasis and periodontal health in children and adults. J Dent Res 2014;93:231–237.
10. Aytekin C, Germeshausen M, Tuygun N, Tanir G, Dogu F, Ikinciogullar A. Eponym: Kostmann disease. Eur J Pediatr 2010;169:657–660.
11. Mortellaro C, Garagiolia U, Carbone V, Cerutti F, Marci V, Foglio Bonda PL. Unusual oral manifestations and evolution in glycogen storage disease type 1b. J Caniofac Surg 2005;16:45–52.
12. Mornet E. Hypophosphatasia. Orphanet J Rare Dis 2007; 2:40–48.
13. Meyle J, Gonzáles JR. Influences of systemic diseases on periodontitis in children and adolescents. Periodontol 2000 2001;26:92–112.
14. Madrigal-Martínez-Pereda C, Guerrero-Rodríguez V, Guisado-Moyo B, Meniz-García C. Langerhans cell histiocytosis: literature review and descriptive analysis of oral manifestations. Med Oral Patol Oral Cir Bucal 2009;14: E222–228.
15. Malt EA, Dahl RC, Haugsand TM, Ulvestad IH, Emilsen NM, Hansen B, Cardenas YE, Skøld RO, Thorson AT, Davidsen EM. Health and disease in adults with Down syndrome. Tidssk Nor Legeforen 2013;133:290–294.
Peter Eickholz, Beate Schacher, Katrin Nickles
Endodontal-parodontale Läsionen7Ätiologie
Endodont und Parodont liegen räumlich eng benachbart und sind nur vom Dentin der Zahnwurzel getrennt. Pathologische Prozesse können sich von einer Struktur in die andere ausbreiten und es können sogenannte endodontal-parodontale (Endo-Paro-)Läsionen entstehen. Parodontalerkrankungen, die im Zusammenhang mit solchen Endo-Paro-Läsionen stehen, bilden in der Klassifikation der parodontalen und periimplantären Erkrankungen und Zustände einen eigenen Unterpunkt1–3. Über das Foramen apicale, aber auch über zahlreiche akzessorische Wurzelkanäle, die lateral oder in die Furkationen mehrwurzeliger Zähne münden, stehen beide Gewebe in direkter Verbindung (Abb. 1). In einer nekrotisierten Pulpa kommt es zu Vermehrung und Zerfall von Mikroorganismen. Von den Bakterien, die besonders häufig in den Wurzelkanälen avitaler endodontisch unversorgter Zähne gefunden werden, gehören Porphyromonas gingivalis, Prevotella intermedia, Fusobakterien und Spirochäten auch zu den parodontalpathogenen Mikroorganismen4,5. Enzyme und Zerfallsprodukte dieser Bakterien können über Wurzelkanäle ins Parodont gelangen und dort entzündliche Reaktionen, Degradation kollagener Fasern und Osteolyse verursachen. Gelangen diese bakteriellen Produkte über das Foramen apicale ins Parodont, was als häufigste Möglichkeit zu betrachten ist, kommt es zu einer periapikalen Osteolyse, die röntgenologisch darstellbar ist (lesion of endodontic origin: LEO).
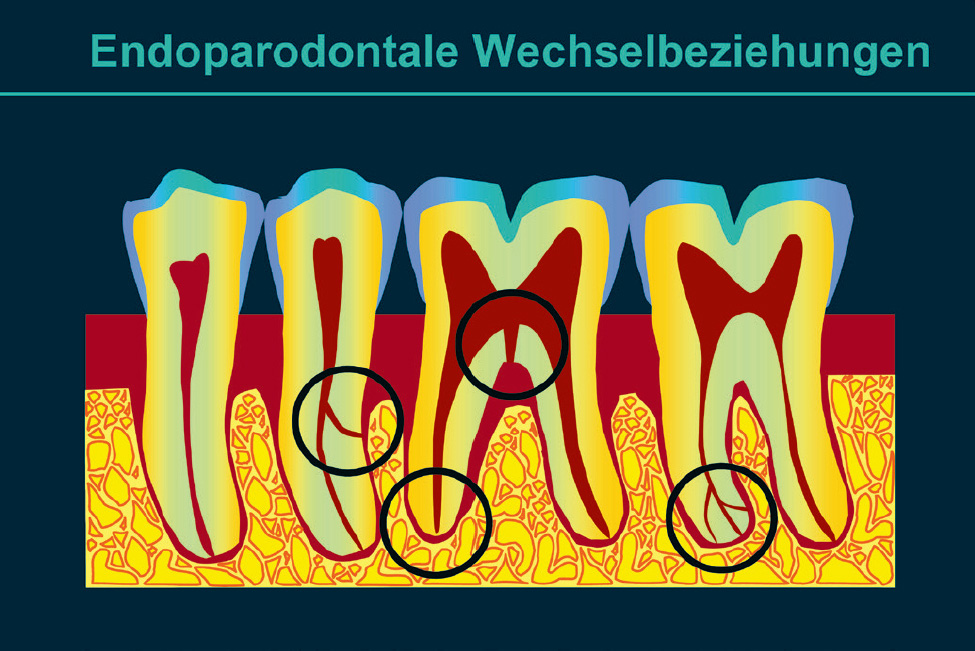
Abb. 1 Endodont und Parodont liegen räumlich eng benachbart und sind nur vom Dentin der Zahnwurzel getrennt. Verbindungen sind z. B. das Foramen apicale oder Seitenkanäle der Pulpa, die lateral oder in die Furkationen mehrwurzeliger Zähne münden.
Von der Ätiologie aus betrachtet ist es möglich, dass Defekte primär einen endodontalen Ursprung haben, sich ausbreiten und auch das Parodont in Mitleidenschaft ziehen (Abb. 2a)6. Der Weg bakterieller Produkte und Antigene über einen lateralen Wurzelkanal kann zu einer lateralen Osteolyse führen, die im Röntgenbild einen vertikalen Knocheneinbruch vortäuschen kann. Die Ausbreitung über einen interradikulären Seitenkanal kann zu einer interradikulären Osteolyse führen, die in ihrer röntgenologischen Darstellung den Verdacht eines Furkationsbefalls rechtfertigt. Solche lateralen bzw. interradikulären Prozesse können zum Parodont perforieren und so zu einer parodontalen Beteiligung und bei längerem Persistieren zu einer Superinfektion führen. Erreichen andererseits tiefe intraalveoläre Läsionen die periapikale Region, kann es zur Fortleitung der Infektion von marginal nach endodontal und zur retrograden Pulpitis kommen. Hierbei handelt es sich dann um eine primär parodontale Läsion (Abb. 2b). Es gibt allerdings auch Situationen, in denen ein primär parodontaler Prozess und eine primär endodontale Läsion unabhängig voneinander entstehen, aufeinander „zuwachsen“ und unter Umständen konfluieren (Abb. 2c). Klassifikationen, die sich primär auf die Ätiologie der endodontal-parodontalen Läsionen beziehen7,8, sind allerdings für die Differenzialdiagnose zwischen primär endodontalen und primär parodontalen Läsionen wenig geeignet. Die gültige Klassifikation der parodontalen und periimplantären Erkrankungen und Zustände von 2018 sieht eine Einteilung vor, die zunächst unterscheidet, ob die Wurzel beschädigt ist (z. B. Wurzelfraktur) und bei Läsionen ohne Beschädigung der Wurzel Patienten mit und ohne Vorliegen einer Parodontitis differenziert (Tab. 1)9.
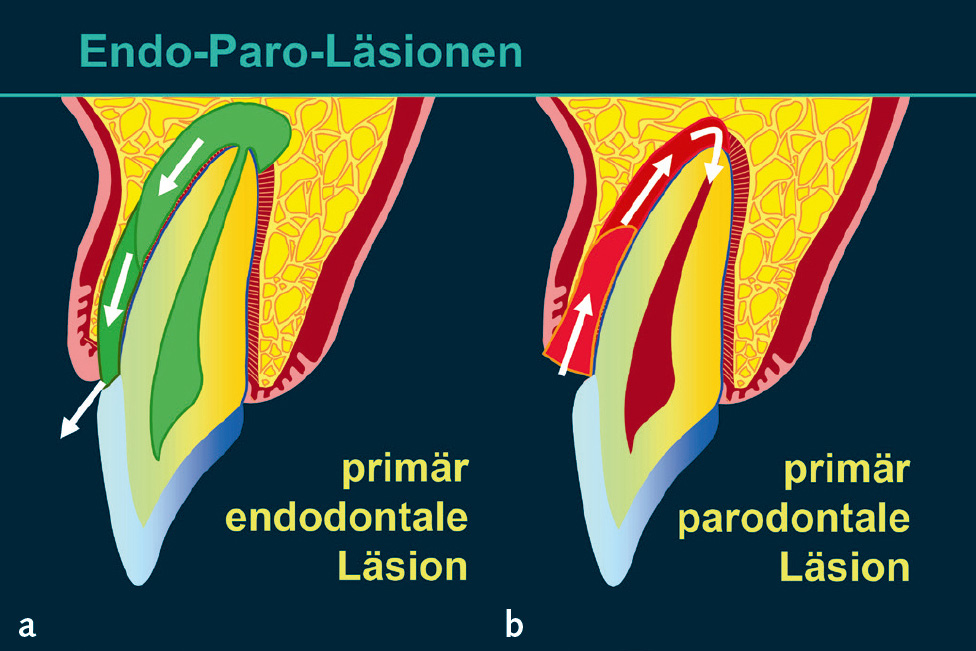
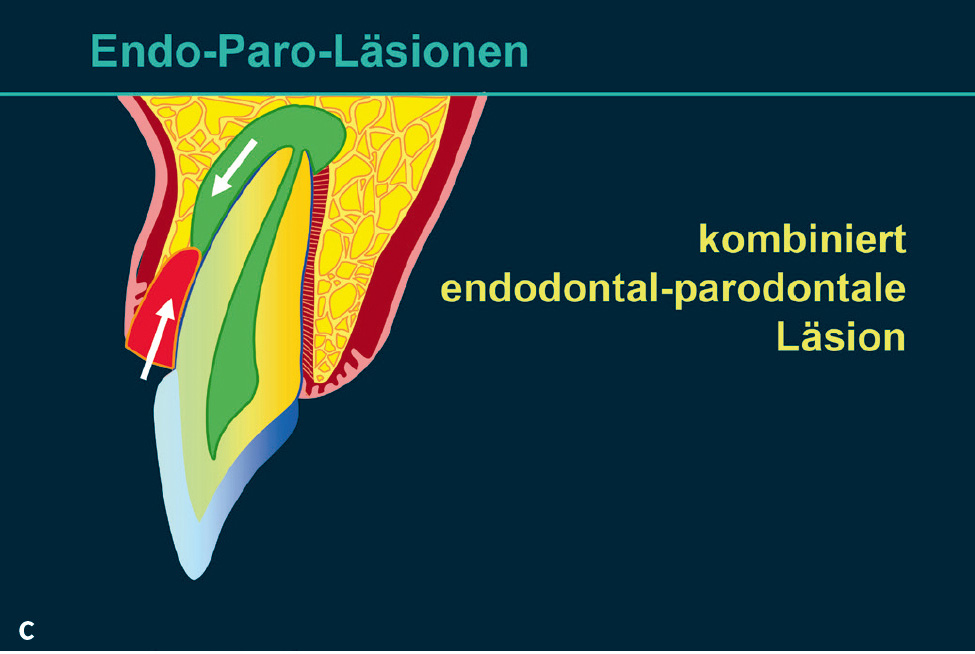
Abb. 2 Endodontal-parodontale Läsionen: a) primär endodontale Läsion; b) primär parodontale Läsion; c) kombinierte EndoParo-Läsion.
Tab. 1 Klassifikation endodontal-parodontaler Läsionen nach der aktuellen Klassifikation9.
Endodontal-parodontale Läsion mit Beschädigung der WurzelWurzelfraktur oder -rissPerforation eines Wurzelkanals oder der Pulpakammerexterne WurzelresorptionEndodontal-parodontale Läsion ohne Beschädigung der Wurzelbei Parodontitis-PatientenGrad 1 – enge, tiefe parodontale Tasche an einer Seite des ZahnsGrad 2 – weite, tiefe parodontale Tasche an einer Seite des ZahnsGrad 3 – tiefe parodontale Tasche an > 1 Seite des Zahnsbei Patienten ohne ParodontitisGrad 1 – enge, tiefe parodontale Tasche an einer Seite des ZahnsGrad 2 – weite, tiefe parodontale Tasche an einer Seite des ZahnsGrad 3 – tiefe parodontale Tasche an > 1 Seite des ZahnsAkute periapikale Prozesse können Knochen und Schleimhaut perforieren und zu vestibulärer oder oraler Fistelung führen (Abb. 3). Der Eiter kann aber ebenso den Knochen penetrieren und sich submukös seinen Weg nach marginal suchen (marginale Suppuration, erhöhte Sondierungstiefe im gesamten Bereich der Eiterung: endodontalparodontale Läsion ohne Beschädigung der Wurzel bei Patienten ohne Parodontitis: Grad 2; Tab. 1) (Abb. 4) oder aber seinen Weg über den Parodontalspalt suchen und marginal abfließen (marginale Suppuration, streng isoliert erhöhte Sondierungstiefe: endodontal-parodontale Läsion ohne Beschädigung der Wurzel bei Patienten ohne Parodontitis: Grad 1; Tab. 1) (Abb. 5). In den beiden letzten Fällen ist die Symptomatik dem klinischen Bild eines Parodontalabszesses vergleichbar.
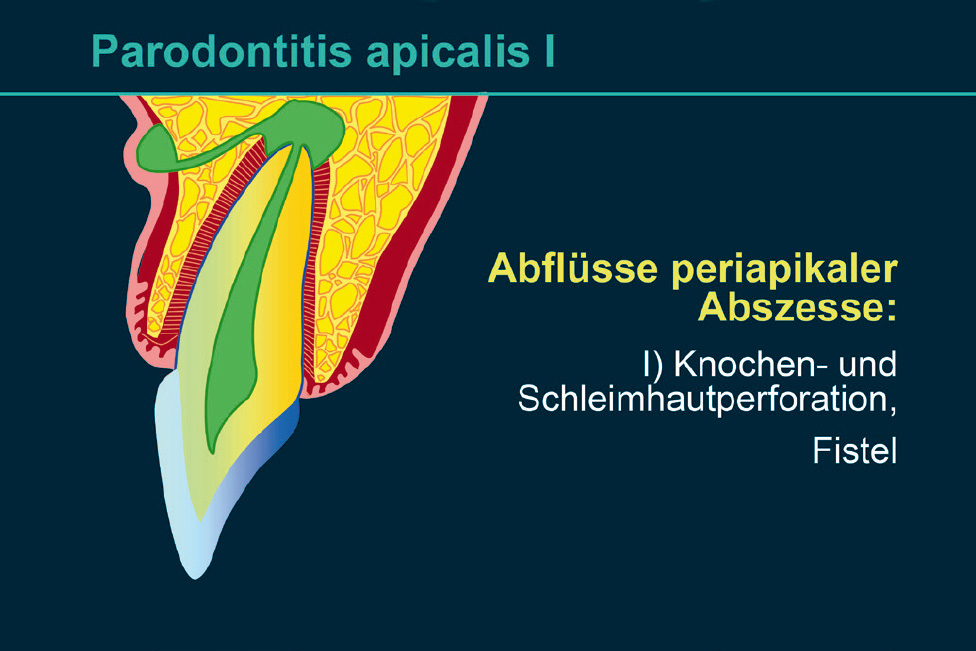
Abb. 3 Parodontitis periapicalis mit Fistelung nach vestibulär.
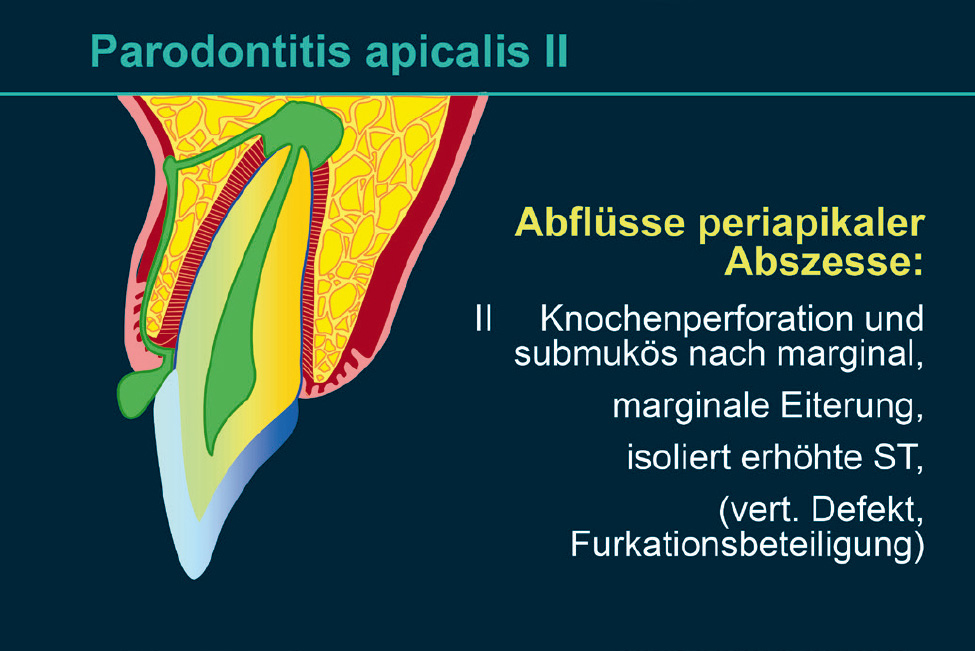
Abb. 4 Parodontitis periapicalis mit submuköser Fistelung nach marginal.
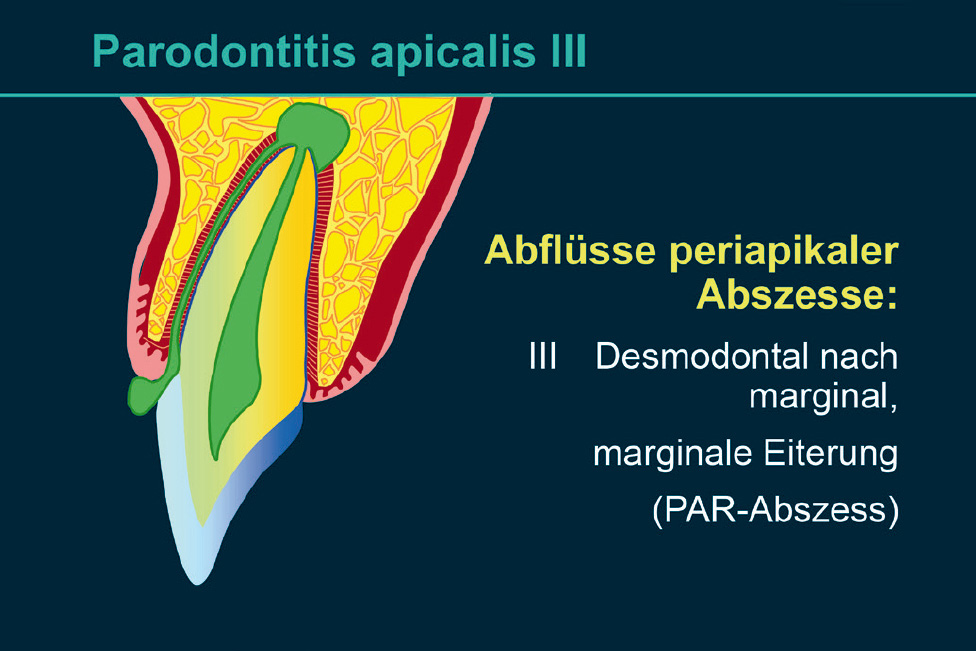
Abb. 5 Parodontitis periapicalis mit desmodontaler Fistelung nach marginal.
Perforationen vom Pulpakavum in den Desmodontalspalt (endodontal-parodontale Läsion mit Beschädigung der Wurzel: Perforation des Wurzelkanals/der Pulpakammer; Tab. 1) können, insbesondere wenn sie nicht unmittelbar und adäquat versorgt werden, zu Defekten führen, die ähnlich wie endodontale Läsionen, die über Seitenkanäle der Pulpa z. B. die Furkation eines mehrwurzeligen Zahns erreichen, von primär parodontalen Defekten schwer zu unterscheiden sind (Abb. 6).
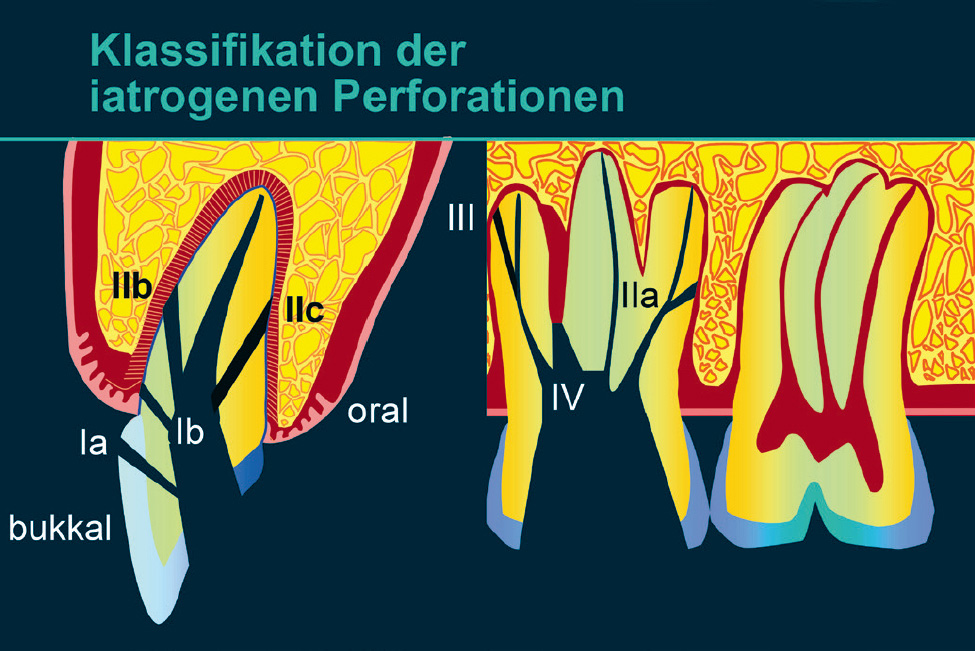
Abb. 6 Klassifikation der iatrogenen Perforationen8: Klasse Ia: Perforation koronal des Gingivalsaums; Klasse Ib: Perforation apikal des Gingivalsaums, aber suprakrestal; Klasse II: approximale infraalveoläre Perforation im koronalen und mittleren Wurzeldrittel (a: approximal; b: vestibulär; c: oral); Klasse III: Perforation im apikalen Wurzeldrittel; Klasse IV: Perforation in die Furkation mehrwurzeliger Zähne.
Eine weitere Ursache für isolierte tiefe parodontale Defekte sind vertikale Wurzelfrakturen wurzelkanalgefüllter Zähne (endodontal-parodontale Läsion mit Beschädigung der Wurzel: Wurzelfraktur; Tab. 1). Diese Frakturen können als Ermüdungsbrüche, verursacht durch zunehmende Versprödung der wurzelkanalgefüllten Zähne, als Folge zu starker Ausschachtung bei der Aufbereitung der Wurzelkanäle und daraus resultierender Schwächung der Zahnhartsubstanz bei normaler Belastung oder durch Traumata entstehen2. Reicht der Frakturspalt bis nach marginal, wird er bakteriell besiedelt. So kann es infolge dieser bakteriellen Besiedlung zur Zerstörung des Parodonts entlang des Frakturspaltes und zu einem isolierten tiefen Defekt kommen (Abb. 7).
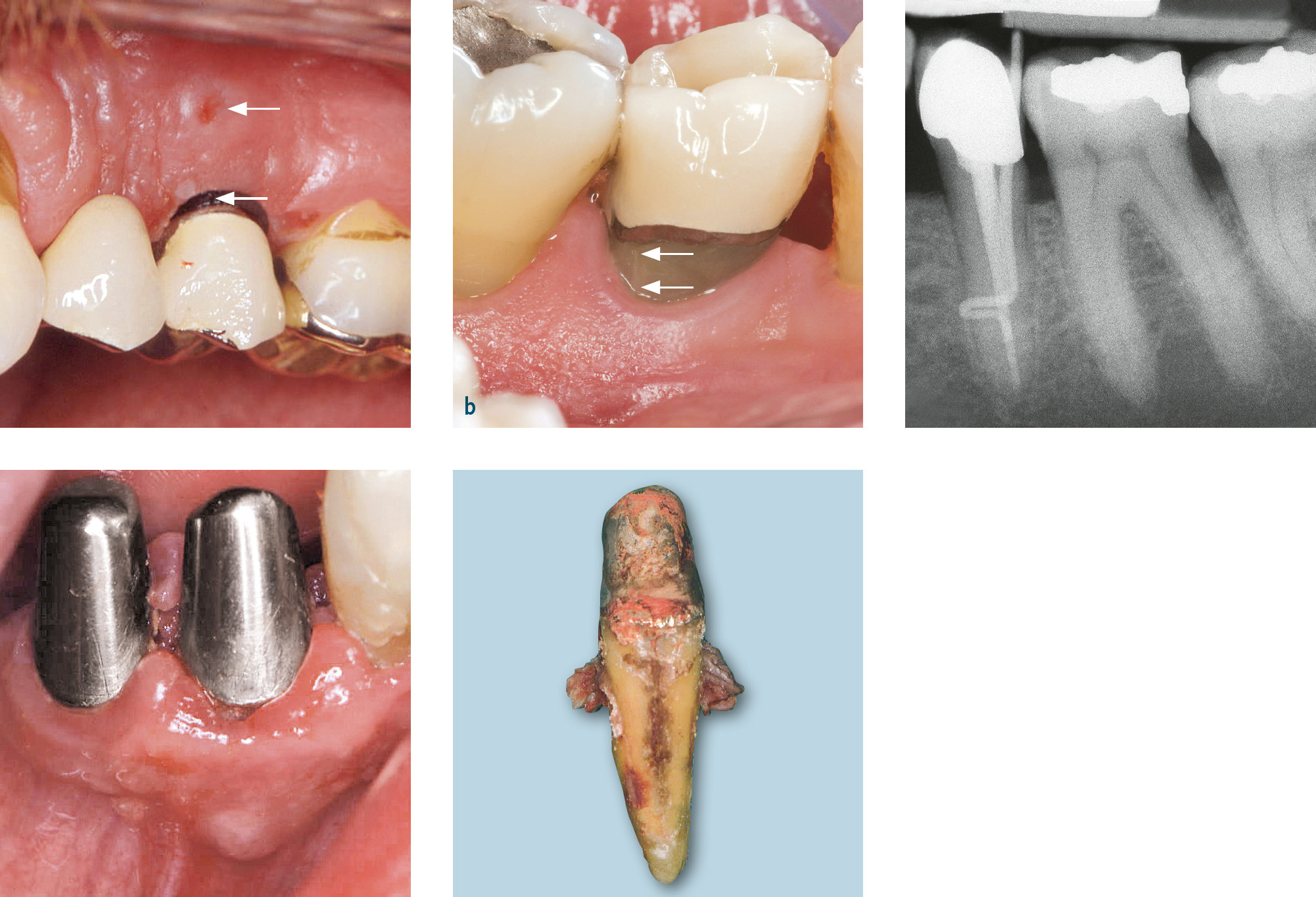
Abb. 7 Vertikale Wurzelfrakturen: a) Zahn 25: intrakanaläre Stiftverankerung, vestibuläre Sondierungstiefe 9 mm, verstibuläre Fistel (oberer Pfeil), zwischen Gingiva und Kronenrand Frakturspalt sichtbar; b) Zahn 35: linguale Sondierungstiefe 10 mm, Frakturspalt sichtbar (Pfeile); c) Röntgenbild zu Abb. 7b mit Guttaperchaspitze im Fistelgang; d) Zahn 43: Wurzelkanalfüllung, Stiftkernaufbau, Beschwerden, perkussionsempfindlich, vestibuläre druckdolente Schwellung, Sondierungstiefe 11 mm, marginale Suppuration; e) Zahn 43 aus Abb. 7d nach Extraktion: Der Frakturspalt ist sichtbar, an dem entlang sich Konkremente nach apikal erstrecken.
Diagnostik
Die Wechselwirkungen zwischen Parodont und Endodont gestalten die Differenzialdiagnose primär endodontisch oder primär parodontal verursachter Prozesse schwierig und erfordern eine sehr genaue Diagnostik. Verschiedene Symptome können sowohl endodontalen als auch parodontalen Ursprungs sein (Übersicht 1).
Übersicht 1 Symptome, die sowohl endodontalen, als auch parodontalen Ursprungs sein können.
• Erhöhte Sondierungstiefen• Marginale Suppuration• Schwellung der Gingiva• Fistelbildung• Perkussionsempfindlichkeit• Erhöhte Zahnbeweglichkeit• Horizontale Attachmentverluste• Vertikale Knocheneinbrüche (Röntgen)• Interradikuläre Osteolyse (Röntgen)Das Leitsymptom für die Differenzierung primär endodontal bzw. parodontal verursachter Läsionen ist die Sensibilität des Zahnes auf Kälte oder galvanischen Strom. Bei negativer Sensibilität liegt eine endodontische, bei positiver Sensibilität eine parodontale Ursache nahe. Bei mehrwurzeligen Zähnen ist dieses Kriterium jedoch häufig trügerisch. Partielle Pulpanekrosen können zu periapikalen, lateralen oder interradikulären Osteolysen oder Eiterungen führen, während die Restvitalität des nichtnekrotischen Pulparestes nach wie vor für einen positiven Sensibilitätstest sorgt.
Die Differenzialdiagnose zwischen primär endodontaler Läsion bei partieller Pulpanekrose und tiefer primär parodontaler Läsion, die zu einem Parodontalabszess geführt hat, ist diffizil. Hilfreich ist es, bei der Röntgendiagnostik einen röntgenopaken Stift (z. B. Guttaperchapoint) in die Fistel/parodontale Tasche einzuführen (Abb. 7c, 8). So lässt sich häufig der Ursprung der Eiterung (z. B. periapikale Region) darstellen. Hinweise für eine primär endodontal verursachte Läsion sind kariöse Läsionen (Abb. 8b) oder pulpanahe Restaurationen und Kronen2. Bei etwa 10 % der Kronen kommt es in den ersten 10 Jahren nach Präparation zu Pulpanekrosen. Bei einem Patienten, der generell keine oder wenig Attachmentverluste oder Knochenabbau und nur isoliert an einer Stelle eine stark erhöhte Sondierungstiefe mit Suppuration aufweist (endodontal-parodontale Läsion ohne Beschädigung der Wurzel bei Patienten ohne Parodontitis: Grad 1), sprechen die Befunde für eine primär endodontale Läsion (Abb. 7c, 8). Ein Patient, der auch an anderen Stellen lokalisiert oder generalisiert tiefe Taschen sowie Knochenabbau zeigt, bei dem aber der Beschwerden bereitende Zahn endodontisch nicht vorgeschädigt ist, hat mit hoher Wahrscheinlichkeit eher ein primär parodontales Problem. Eine periapikale hypodense (radiotransluzente) Zone auf zweidimensionalen Röntgenbildern muss kein eindeutiger Hinweis auf eine Läsion primär endodontaler Genese sein. Die dreidimensionale Ausdehnung primär parodontaler Knochentaschen kann je nach Projektion periapikale Osteolysen vortäuschen (Abb. 9).
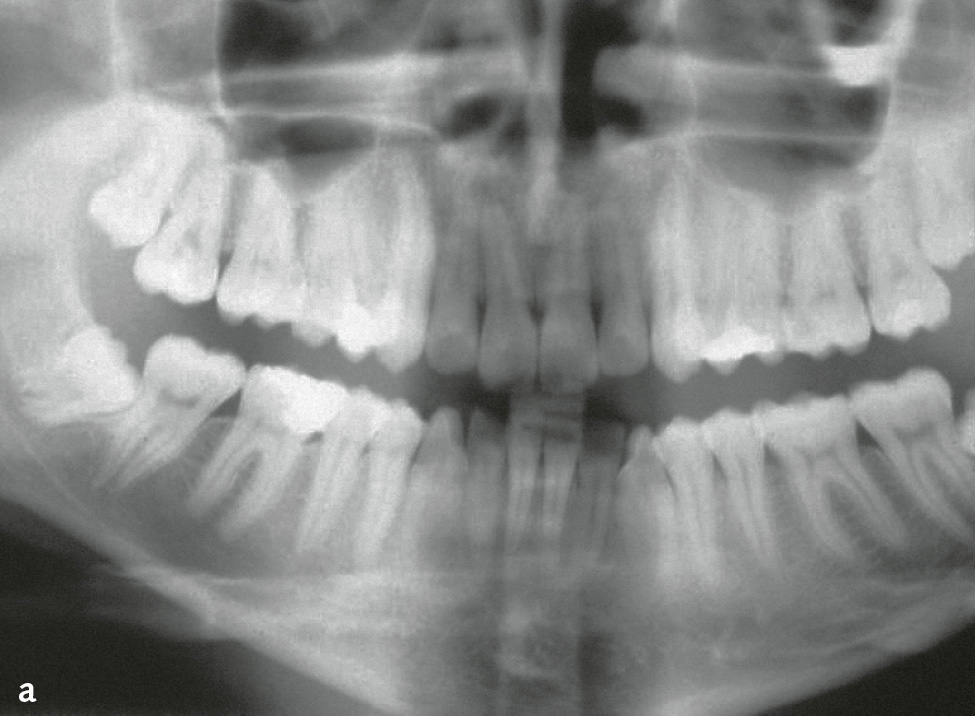
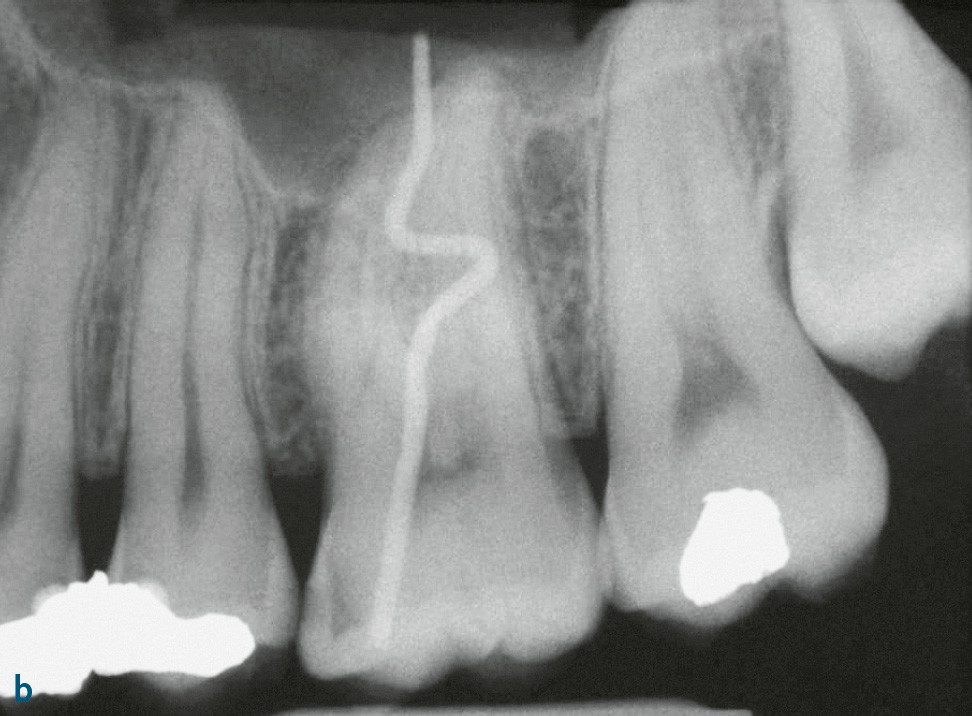
Abb. 8a, b Jugendlicher Patient mit Beschwerden an Zahn 26. Klinisch findet sich mesiobukkal 26 eine Sondierungstiefe von 11 mm mit Suppuration; der Zahn reagiert positiv auf Sensibilitätstest. Ein Vorbehandler hatte bereits die Diagnose Parodontalabszess gestellt und ein subgingivales Scaling durchgeführt, bevor er zur systematischen Parodontalbehandlung überwies. a) Panoramaschichtaufnahme: kein Anhalt auf Knochenabbau; b) Zahnfilm 26 mit Guttaperchapoint in der mesiobukkalen Tasche: mesial bis ins Dentin reichende Karies, der Guttaperchapoint reicht bis in die periapikale Region. Diagnose: akute Parodontitis periapicalis ausgehend von partieller Pulpanekrose an 26. Die Chance für ein Reattachment nach Wurzelkanalbehandlung war allerdings durch das subgingivale Scaling vergeben worden.
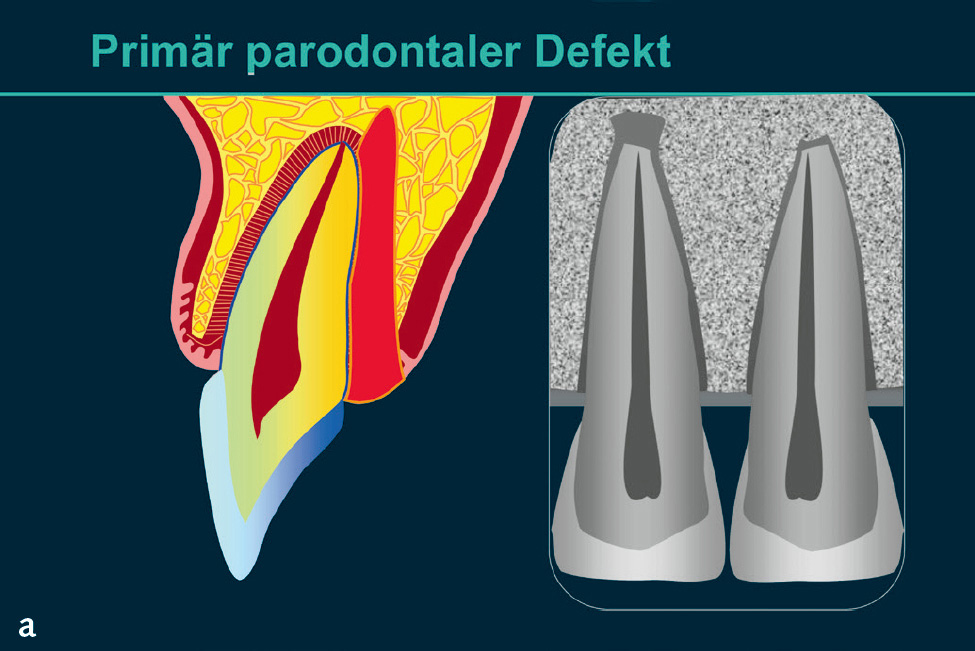
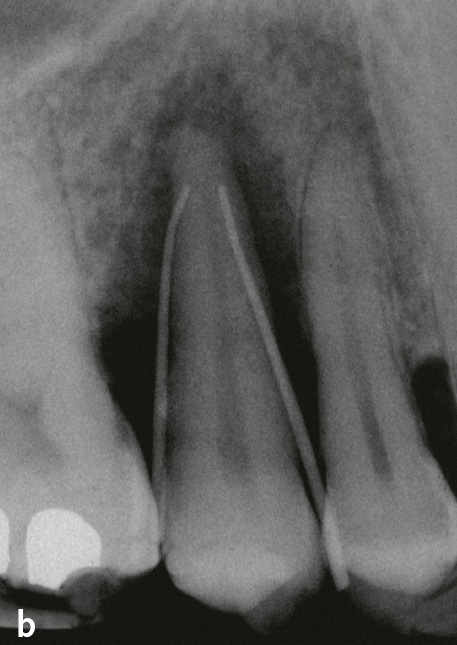
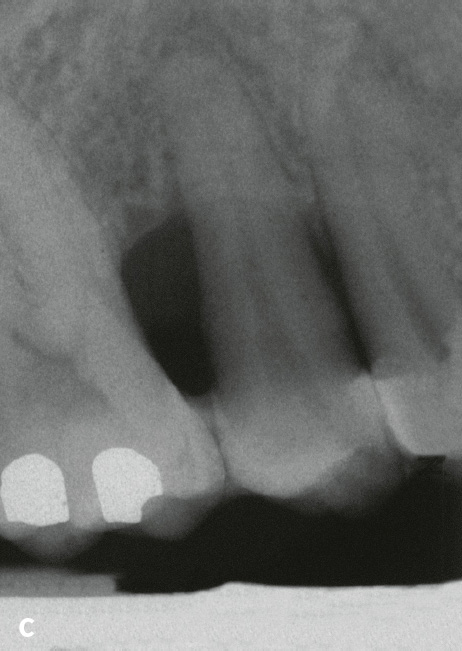
Abb. 9 Palatinaler Knochendefekt primär parodontalen Ursprungs, dessen apikale Ausdehnung sich als periapikale hypodense (radiotransluzente) Zone auf das Röntgenbild projiziert: a) schematisch (nach10); b) Röntgenbild von Zahn 15 mit Guttaperchaspitzen in den parodontalen Taschen (Sondierungstiefen [ST] an allen 3 palatinalen Stellen 11 mm, Mobilität Grad III)11; c) Röntgenbild 7 Monate nach Schienung mit Komposit in Säure-Ätz-Technik und subgingivaler Instrumentierung mit systemischer Antibiotikagabe: knöcherne Auffüllung, ST maximal 5 mm11.
Auch die Geschwindigkeit, mit der eine Läsion voranschreitet, kann Hinweise auf die Genese geben: Parodontitis ist eine chronische Erkrankung mit zumeist langwierigem Verlauf. Entsteht isoliert an einer Stelle innerhalb von nur 2 Jahren ein Knocheneinbruch, der bis ins apikale Wurzeldrittel reicht, sind eine primär endodontale Genese oder eine vertikale Wurzelfraktur sehr wahrscheinlich (Tab. 2). Ein weiteres Unterscheidungskriterium kann die Form der knöchernen Läsionen sein: Nach koronal weite und sich nach apikal v-förmig verengende Defekte weisen auf Läsionen primär parodontalen Ursprungs hin, während runde und halbrunde Querschnitte, bei denen sich der Knochen nach koronal wieder verengt, eher auf primär endodontale Läsionen hinweisen (Tab. 2, Abb. 10). Die knöcherne Läsion hat dort ihren größten Durchmesser, wo sie ihren Ausgang nahm.
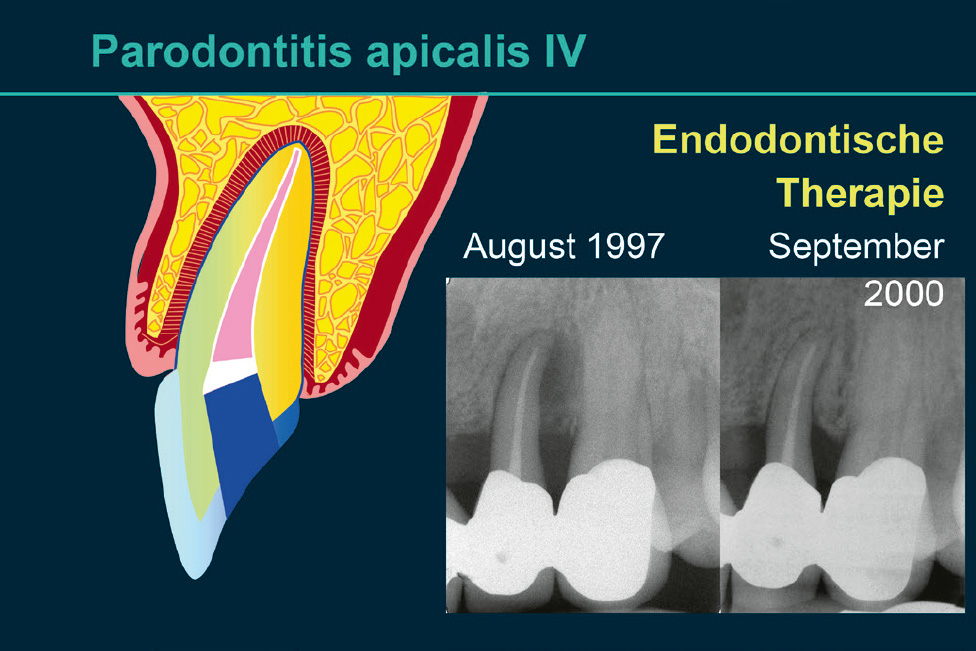
Abb. 10 Der endodontal verursachte Entzündungsprozess zerstört die Verbindung zwischen den im Knochen und im Wurzelzement verankerten Desmodontalfasern. Der proximale Anteil dieser Fasern bleibt aber anscheinend zumindest anfangs intakt (Abb. 5), sodass sich nach Eliminierung der endodontalen Entzündungsursache durch Wurzelkanalbehandlung die Kontinuität der Desmodontalfasern wiederherstellen kann. Röntgenaufnahmen von Zahn 22, der bei Erstbefundung asensibel auf Kältetest reagierte: August 1997: Masterpoint-Röntgenaufnahme: Distal erstreckt sich eine knöcherne Läsion vom Limbus alveolaris bis zum Apex. Die knöcherne Läsion hat ihre größte Ausdehnung im apikalen Wurzeldrittel; September 2000: nahezu vollständige Auffüllung des Knochendefekts nach Desinfektion und Füllung des Wurzelkanals.






