Introducció a l'enginyeria dels reactors químics

- -
- 100%
- +
2. El balanc. de matèria aplicat a un RCTA, en el qual es desenvolupa la reacció A → productes, en fase líquida, irreversible i de primer ordre, condueix a X = Da/(1 + Da), on Da és el producte τk i es coneix com a mddul de Damköhler. Es tracta d’un mddul adimensional que proporciona una estimació del grau de conversió que es podrà aconseguir, així, si Da ≤ 0.1 es tindrà X ≤0.1, mentre que si Da ≥ 10, llavors X ≥ 0.9. Trobeu una equació semblant a aquesta per a una reacció irreversible de segon ordre i la mateixa estequiometria, en la qual apareixerà un nou mddul de Damköhler (Da), que en aquest cas es correspondrà amb el producte τ K CAo. Comproveu que ara Da és també adimensional, i calculeu la conversió que correspon a Da = 0.1 i Da = 10.
3. Ouina de les següents expressions es correspon amb el balanç molar de Aj en un RDTA de V constant?
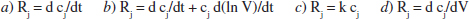
4. En un reactor intermitent reacciona 1’1 % de A en 1 minut quan cA ≌ 1 mol/L, i reacciona també un 1 %, però en 15 segons, quan cA ≌ 4 mol/L. Trobeu una equació de velocitat per a representar la reacció de A.
5. Apliqueu el balanc. de matèria a un RCTA en estat estacionari, en el qual té Hoc en fase líquida i de manera isoterma una reacció elemental de dimerització 2 A → B.
6. La reacció A → B que és d’ordre -1 es desenvolupa en un RDTA.
a) Escriviu una equació que represente la variació de la concentració de A en funció del temps.
b) Escriviu una equació que permeta calcular el temps necessari perquè la concentració de A descendisca al 10 % del seu valor inicial.
c) Podrà completar-se aquesta reacció?, podria fer-ho si fóra de primer ordre?
7. Trieu i justifiqueu:
α) Quan no s’utilitza un RDTA?
a) Per a produir productes cars.
b) Per a proves de nous productes.
c) Per a minimitzar reaccions laterals.
d) Per al processament de gran quantitat de material.
β) L’agitació és important en:
a) Tots els reactors ideals.
b) Tots els reactors ideals excepte el tubular.
c) Tots els reactors ideals excepte el discontinu.
d) Cap reactor ideal.
8. A quin dels sistemes següents s’aplica l’expressió Rj = dc/dt?
a) RDTA de V constant.
b) RDTA de V variable.
c) RCTA en estat estacionari.
d) RCTA de V constant.
9. L’expressió dcj /dt = 0 indica que no té Hoc cap reacció en el sistema?
a) Depèn del sistema.
b) No.
c) Depèn de l’hora del dia.
d) Sí.
10. L’anhídrid ftàlic es pot produir per oxidació de naftalè segons l’esquema de reacció: 2 C10H8 + 9 O2 → 2C8H4O3 + 4H2O + 4CO2. Construïu una taula estequiomètrica per a aquesta reacció quan es desenvolupa en un RDTA de volum constant, partint d’una mescla inicial que conté un 15 % de naftalè i un 85 % d’aire (% molars). En aquesta taula ha d’aparèixer la pressió parcial i la concentració de cada espècie en funció de la conversió de naftalè. Així mateix, escriviu una expressió per a la pressió total, també en funció de la conversió de naftalè.
11. Estem estudiant una reacció amb un RDTA; quan vam trobar les condicions més adequades, el temps de reacció per a aconseguir la conversió desitjada és 10 min. Si aquesta mateixa reacció i en les mateixes condicions es vol portar a terme en un reactor continu de 500 L, quin cabal ha de circular per a aconseguir la mateixa conversió en: a) un RCTA b) un RFP?
12. La reacció en fase gas 2 A + B → 2 C és irreversible i de primer ordre respecte de A, i de segon ordre respecte de B. Trieu l’expressió correcta entre les següents de forma raonada:
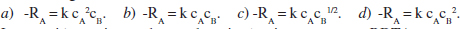
13. Considereu la reacció en fase gas en què un dels productes condensa immediatament després de ser format: A(g) + 2 B(g) → C(g) + D(l). La reacció és de primer ordre respecte de A i de primer ordre respecte de B. Escriviu l’equació de velocitat en funció únicament de X, considerant que la reacció es desenvolupa isotèrmicament en un reactor tubular, F aliment és equimolar en A i en B, es pot menysprear el volum de líquid format. Dades i Notes. k = 104 L/ mol s. cA = 0.02 mol/L. T = 32 "C. Pressió de vapor de D = 1 mm Hg.
14. Calculeu el temps necessari per a obtenir un 75 % de conversió en un RDTA per al sistema A → R, sabent que es necessita una hora per a aconseguir una conversió del 50 % i que la cinètica és de primer ordre. Raoneu la resposta. Es valorarà 1'absèntia de càlculs.
Problemes
1. Determineu la relació X-τ per a la reacció del problema 2.9 en un RCTA i en un RFP, ambdós isoterms. Per a aquests reactors, calculeu la conversió que s’aconseguiria per a distintes temperatures i un τ = 10 min. Repetiu el càlcul per a altres valors del temps espacial (5 i 1 min). Representeu aquestes variations sobre el diagrama obtingut en el problema 2.9.
2. Es vol obtenir acetat de butil en un RDTA que ha de treballar a 100 °C (isotèrmicament). La mescla initial estarà constituïda per butanol i àcid acètic, en la proporció molar de 4.97:1. Així mateix, contindrà un 0.032 % en pes de fLSC", que actua com a catalitzador. Calculeu:
1) El temps necessari per a assolir un grau de conversió del 50 %.
2) Per aquest grau de conversió, la quantitat initial de cada reactiu per càrrega i el volum útil del reactor necessaris, si es vol obtenir una producció de 50 kg/h, utilitzant un sol reactor i sabent que la càrrega, descàrrega i posada al punt, entre cada dues operations consecutives, costa 30 min. Es partirà de la mescla initial indicada en el primer paràgraf.
Dades i Notes. Per al sistema en qüestió, la velocitat de reacció és de segon ordre respecte a l'acid acètic, és a dir, r (kmol/m3 s) = k c12, on k = 0.29 10-3 m3/kmol de A1 s. Les propietats físiques dels components del sistema es mostren en la taula P3.2. Encara que la densitat de la mescla reactiva varia amb la conversió, l’excés de butanol utilitzat redueix la magnitud del canvi. Per tant, en primera aproximació, la densitat mitjana del conjunt pot considerar-se constant al llarg de la reacció i igual a 750 kg/m3.
TAULA P3.2
Propietats físiques dels components del sistema

3. Es vol hidrolitzar anhídrid acètic en un RCTA isoterm en què inicialment s’introdueixen 10 L d’una solució aquosa que conté 0.5 10-4 kmol/m3 d’anhídrid acètic. En una operació típica de posada en marxa, es connecta l’agitador, una vegada s’ha introduït la càrrega inicial, i s’escalfa el reactor fins que la mescla aconsegueix la temperatura de reacció: 313 K. A continuació, comença a introduir-se en el reactor un corrent consistent en una dissolució aquosa d’anhídrid acètic, la concentració de la qual és de 3 10-4 kmol d’anhídrid/m3, amb un cabal volumètric de 0.12 m3/h, mentre que es drena constantment un corrent de producte d’igual cabal volumètric. Si la reacció és irreversible i de primer ordre respecte a l’anhídrid acètic, calculeu la concentració d’aquest component i d’àcid acètic en la dissolució que ix del reactor al cap d’un temps de reacció de 3 min i al cap d’un temps de reacció infinit. Compareu aquests valors amb la situació corresponent a l’estat estacionari. Dades i Notes. Es pot admetre que la densitat de la mescla reactiva roman constant durant tota la reacció. A la temperatura de reacció, la constant de velocitat val k = 6.33 10-3 s-1. Suposeu que la reacció està pràcticament conge-lada fins al moment en què comença a introduir-se la dissolució d’anhídrid acètic en el reactor.
4. La descomposició tèrmica del n-nonà, a 1000 K i 4.1 atm, té lloc, en fase ga- sosa, d’acord amb el següent esquema de reacció: C9H20 → 4 Productes (34 % C2H4, 19 % CH4, 16 % H2, 16 % C3H8, etc.). És a dir, per cada volum de nonà descompost es formen quatre volums d’una mescla gasosa de la composició indicada. La reacció és irreversible i de primer ordre. La constant de velocitat en les condicions assenyalades val 3.4 s-1. Si la reacció es vol desenvolupar en un RFP isoterm d’1 cm2 de secció, que opera a 1000 K i 4.1 atm abs., i aquest reactor s’alimenta amb un cabal de 400 L/h del reactiu gasós pur, mesurat a les condicions d’operació del reactor, quina serà la longitud necessària de reactor per a aconseguir una conversió del 90 %? Pot menysprear-se la pèrdua de pressió al llarg del reactor.
5. L’etilè és un dels principals compostos químics per volum de producció (darrerament, als EUA era el número 4 en la llista absoluta i el primer en la dels compostos orgànics). El 1990 es van produir 16330 milions de kg, i el seu preu era de 0.53 $/kg. Un 65 % de l’etilè produït es va dedicar a la fabricació de plàstics, un 25 % a l’obtenció d’òxid d’etilè i etilenglicol, un 5 % a la fabricació de fibres i el 5 % restant per a dissolvents. Calculeu el volum d’un RFP necessari per a produir 136 milions de kg/any, per craqueig d’un corrent d’età pur. La reacció és irreversible i elemental. Es vol aconseguir una conversió a l’eixida del 80 %, operant el reactor de manera isoterma a 1100 K i a una pressió de 6 atm. L’esquema de reacció és C2H6 → C2H4 + H2. Si el reactor es construirà amb un banc de tubs del tipus 80 (diàmetre intern 2" i longitud 12 m), que s’instal·laran en paral·lel, quants tubs es necessitaran? Si per a arredonir es decideix posar 100 tubs de les característiques indicades, trobeu el perfil conversió-posició al llarg del reactor. Quina és la conversió aconseguida a l’eixida del reactor? Quina serà la producció anual en aquestes condicions? Dades i Notes. Constant de la velocitat de la reacció a 1000 K: k = 0.072 s-1. Energia d’activació: 82 kcal/mol. Pot suposar-se menyspreable la caiguda de pressió en el reactor.
6. Una reacció elemental, irreversible en fase gas de la forma 2 A1 → A2, es desenvolupa en un reactor tubular (RFP) isoterm a unes condicions de pressió i temperatura donades. Quan l’aliment consisteix en una mescla equimolecular de A1 i un diluent inert, s’aconsegueix un grau de conversió del 80 %. Si el cabal molar del component A1 es reduïra a la meitat, mantenint constant el de l’inert i les condicions de pressió i temperatura, quin seria el grau de conversió a l’eixida del reactor?
7. Un producte alimentari es cuina de forma discontínua. Durant el procés es produeix la desaparició per reacció química (primer ordre) de la vitamina C, la qual cosa es vol evitar o almenys reduir. El procediment habitual té lloc a 121 ºC i dura 20 min.
a) Quina fracció de vitamina C es destrueix en el procés?
b) Es proposa augmentar la temperatura d’operació a 130 ºC per a escurçar el temps de processament i reduir així les pèrdues de vitamina C. Quin és el nou temps de cocció i quin l’efecte sobre la destrucció de vitamina C?
Dades i Notes. Les constants cinètiques del procés de cuinat i de la destrucció de vitamina C són 3.20 10-3 i 1.57 10-4 s-1, respectivament, a 121 ºC. Les energies d’activació del procés de cuinat i de la destrucció de vitamina C són 142 i 58 kJ/mol, respectivament.
8. En un RCTA s’està desenvolupant una reacció de primer ordre A1 → A2. S’ha de procedir a la revisió quinquennal, per la qual cosa que procedim a parar-lo. El procediment utilitzat per a la parada consisteix a interrompre l’aliment, mantenint el mateix cabal d’eixida, és a dir, a partir d’aquest moment Qv manté el seu valor, però Qvo = 0. Demostreu que el model del reactor és ara equivalent al d’un RDTA i que la concentració de A ve donada per
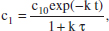
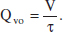
9. La reacció irreversible en fase gas A → 3 Pés d’ordre zero i es desenvoluparà isotèrmicament. Calculeu el temps de reacció necessari per a aconseguir una conversió del 80 % en:
a) Un RDTA de volum constant.
b) Un RDTA de pressió constant.
En aquests dos casos la concentració initial de A és de 2 mol/L, i el sistema conté un 40 % d’inerts.
Calculeu, així mateix, el volum de reactor, el temps i la velocitat espacials, per a aconseguir aquesta conversió en:
c) Un RCTA
d) Un RFP
En tots dos casos s’alimenta un cabal de 2 L/min d’un corrent de la mateixa composició que la mescla reactiva initial del RDTA.
Dades i Notes. La constant de velocitat a la temperatura d’operació val 0.1 mol/L min i l’energia d’activació és de 40 kJ/kmol.
10. Considerem que la reacció irreversible en fase gas 2 A → B + C + 3 D és de segon ordre en A. La mescla reactiva initial està formada per un 50 % de A i un 50 % d’inert. Si la reacció es desenvolupa mantenint constant la pressió i la temperatura, deduïu una expressió que mostre la variació del volum amb la conversió de A. Escriviu una expressió per a la concentració de cada espècie en funció del grau de conversió.
11. La cinètica de les reactions en fase gas sol expressar-se en funció de les pressions parcials, així, per exemple, la reacció A → B + 2 C és de primer ordre, amb r = k PA, k = 50 mol/s m3 bar. Es vol desenvolupar aquesta reacció en un RFP, en el qual s’alimentarà A pur amb un cabal de 10 mol/s. El reactor operarà a 20 bar. Calculeu el volum de reacció necessari per a aconseguir un 50 % de conversió.
12. La reacció irreversible en fase gas 2 A → B + C és de segon ordre, amb r = k PA2, k = 6.7 mol/s m3 bar2. Es vol desenvolupar aquesta reacció en un RFP de secció uniforme, a què s’alimentarà A pur amb un cabal d’1.2 mol/s. La pressió del reactor serà d’1.4 bar a l’entrada, i disminuirà linealment amb la longitud fins a 1 bar a Feixida. Calculeu el volum de reacció necessari per a aconseguir un 90 % de conversió.
13. Es vol utilitzar un RCTA de 4 L per a desenvolupar la reacció elemental, irreversible, en fase líquida: A + B → R, amb k = 1014 exp(-100/RT), on l’energia d’activació ve en kJ/mol i k en L/mol s. La concentració de A i B en l’aliment és de 3 mol/L, i el seu cabal volumètric és 1 L/s.
a) Calculeu la temperatura d’operació que es requereix per a una conversió del 60 %.
b) Determineu el flux de calor que s’ha d’aportar al reactor per a mantenir el sistema en l’estat estacionari si la temperatura de l’aliment és de 290 K.
Dades i Notes. ΔH = 60 kJ/mol. cp = 4.2 kJ/L K.
14. L’espècie A en dissolució amb una concentració de 2 mol/L es converteix en R en un RDTA isoterm, segons una cinètica de primer ordre. En cada cicle d’operació s’aconsegueix la conversió del 95 %. Aquest cicle d’operació dura 4 h, distribuïdes en 3 h de l’etapa de reacció i 1 h de les etapes de càrrega, descàrrega i neteja. El mercat per al producte R ha crescut, per la qual cosa es vol duplicar la capacitat de producció.
a) Quina és la producció original (mol de R/h m3 de reactor) que es vol duplicar?
b) Funciona el reactor en les condicions de màxima producció? En el cas que la resposta siga negativa, quina seria la producció màxima?
c) Quin és el temps de reacció que condueix al màxim benefici?
La continuació d’aquest problema es troba en el 4.8.
Dades i Notes. El cost del reactiu A és 0.30 €/mol, el valor del producte R és de 0.90 €/mol. El cost del reactor és 120 €/ h m3 de reactor. La temperatura d’operació és 363 K.
15. La reacció de descomposició de l’acetona en fase gas és CH3COCH3 → CH2CO + CH4. Aquesta reacció es desenvoluparà en un RFP encamisat. Per la camisa del reactor circula vapor d’aigua a una temperatura prou elevada perquè el funcionament del reactor siga isoterm. El corrent aliment, que consta d’acetona pura, s’introdueix amb un cabal de 8000 kg/h a 1035 K i 1.6 atm. La conversió a l’eixida s’ha fixat en el 20 %, a causa del caràcter inestable del cetè. Determineu el volum (longitud) de reactor necessari per a aconseguir aquest grau de conversió. Determineu, així mateix, el perfil de temperatura del gas calefactor al llarg del reactor (almenys quatre punts dins de l’interval d’interès) necessari per a mantenir constant la temperatura de la mescla reactiva. Justifiqueu la variació trobada. Dades i Notes. La reacció és de primer ordre i la constant de velocitat ve donada per k = exp(34.33 - 34222/T) s-1. La calor de reacció a 1035 K és 78758 J/mol i les calors específiques dels components (J/mol K) són: 166.9 (acetona), 84.7 (cetè) i 73.0 (metà). El RFP està format, en realitat, per un banc de 1000 tubs (1.000 reactors RFP iguals funcionant en paral·lel) d’1" nominal (diàmetre = 0.0266 m). Es pot considerar que el sistema funciona a P constant. El coeficient de transferència de calor per a aquest sistema val 110 W/m2 K.
16. L’òxid d’etilè és un dels principals compostos químics per volum de producció. El 1997, als EUA, se’n van produir uns 3 milions de tones, amb un preu de 1.3 $/kg. Un 60 % de l'òxid d’etilè produït es va dedicar a la fabricació d’etilenglicol.
Calculeu el volum d’un RFP necessari per a produir òxid d’etilè a partir de l’oxidació catalítica d’etilè amb aire. L’esquema de reacció és
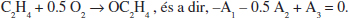
Es vol assolir un 60 % de conversió. Els reactius s’alimenten en la proporció estequiomètrica, el cabal d’alimentació de l’etilè és de 0.14 kmol/s, i la pressió de l’aliment és 10 atm. El reactor conté el catalitzador com un rebliment i opera de forma isoterma a 260 °C.
Si el reactor es constraint amb 10 bancs de tubs del tipus 40 (diàmetre intern 1.5"), amb 100 tubs per banc, quina serà la longitud d’aquests tubs?
Pot suposar-se en primera aproximació menyspreable la caiguda de pressió en el reactor. Repetiu el càlcul considerant la pèrdua de pressió en el reactor. Dades i Notes. Es pot aproximar que les propietats de la mescla reactiva són les de l’aire a les mateixes condicions de pressió i temperatura (a 10 atm i 260 °C, ρ = 6.6 kg/m3 i μ = 2.78 105 kg/m s). La densitat aparent de les partícules de catalitzador (diàmetre 0.25”) és de 1922 kg/m3, i la fracció buida del Hit de partícules és 0.45. La cinètica de la reacció ve donada per:
r = k P11/3 P22/3 mol de A1/g cat. h.
Constant de la velocitat de la reacció a 260°C:
k = 0.0141 mol de A1/atm g cat. h.
La solució d’aquest problema es dóna en l’Apèndix II (exemple II.2.4).
17. S’està dissenyant un esterilitzador de flux (continu) que operant a 121 °C per a tractar un cabal de líquid de 1 L/s. La mort de C. botulinum pot considerarse de primer ordre i la constant cinètica a la temperatura d’operació val 0.192 s1. Determineu el volum d’un RCTA i d’un RFP necessaris per a reduir la concentració d’aquest microorganisme en sis ordres de magnitud. Repetiu el càlcul per a 12 ordres de magnitud.
Lectures d’ampliació
ABU-KHALAF, A. M. (1994): «Mathematical modeling of an experimental reaction system», Chemical Engineering Education, 28 (1), pp. 48-51.
— (1996): «Dynamic and steady-state behavior of a CSTR», Chemical Engineering Education, 30 (2), pp. 132-134.
DICKEY, D. J. (1991): «Succeed at Stirred-Tank-Reactor Design», Chemical Engineering Progress, 87 (12), pp. 22-31.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.










