- -
- 100%
- +
Auch Programme lassen sich überlisten
Wie man sieht, können Altern und Tod tatsächlich exakt genetisch gesteuert sein. Die Beispiele aus dem Tier- und Pflanzenreich zeigen gleichzeitig aber auch etwas anderes: Selbst scheinbar streng festgelegte genetische Alterungsprogramme sind variabel, ändern sich und können gezielt unterlaufen werden.
Agaven sterben normalerweise sofort nach dem Blühen ab. Wird der Blühvorgang aber verhindert, lassen sich die Pflanzen praktisch unbegrenzt am Leben halten. Bei unserem gerade erwähnten Tintenfisch genügt es, den erwachsenen Tieren ihre speziellen optischen Drüsen zu entfernen. Dadurch wird das Brutverhalten unterbrochen und die Tintenfische leben etwa dreimal länger als genetisch ursprünglich „vorgesehen“.
In den Genen kodierte Alternsprogramme sind also durchaus keine starren Abläufe, sie werden vielmehr von äußeren Faktoren mitbestimmt. Es ist deshalb möglich, in genetische Abläufe auf indirekte Weise einzugreifen – auch bei uns Menschen. Wie wir später noch sehen werden, ist das gar nicht so kompliziert, wie es das Thema Genetik vermuten lässt.
Suche nach den Todesgenen
Anstatt Alternsprogramme über Umwege zu unterlaufen, kann man den genetischen Code natürlich auch direkt verändern. Vorausgesetzt, man weiß wo. Bei einem Fadenwurm ist das inzwischen gelungen. Wissenschaftlich heißt das Tier Caenorhabditis elegans.
Dieser sehr kleine Wurm ist mittlerweile so gut untersucht, dass alle Gene identifiziert wurden, die für seine Alterung verantwortlich sind. Wissenschaftler konnten das Erbmaterial des Tieres bereits gezielt verändern. Resultate des Eingriffs waren eine verlangsamte Alterung und eine dreimal längere Lebensspanne. Unter anderem produzieren entsprechend genetisch veränderte Tiere größere Mengen von Antioxidantien. Sie sind also besser gegen schädliche Radikale geschützt. (Anmerkung: Radikale sind auch beim Menschen für das Altern mitverantwortlich. Im nächsten Kapitel werden wir uns ausführlich mit ihnen beschäftigen.)
Auf den Menschen übertragen würde das Beispiel des Fadenwurms eine mittlere Lebensdauer von 250 Jahren ergeben. Steckt auch bei uns ein Jungbrunnen in den Genen, wenn wir nur genau nachsehen? Wäre die Antwort ja, könnte sich die Suche allerdings hinziehen. Beim kleinen C. elegans hat die Entschlüsselung sämtlicher Codes viele Jahre gedauert. Dabei besteht sein gesamter Organismus aus gerade einmal 959 Zellen. Etwa ein Drittel davon sind Zellen des Nervensystems. Der Mensch dagegen besitzt schon allein im Nervensystem 1012 Zellen (das ist eine Zahl mit zwölf Nullen). An eine nicht nur theoretische Entschlüsselung der Gensequenzen, die gerade erst gelungen ist, sondern vor allem an eine praktische Nutzung ist dort in den nächsten Jahrzehnten nicht zu denken. Im Übrigen gibt es bisher überhaupt keine Vorstellung davon, wie eine konkrete Anwendung für den Einzelnen überhaupt umsetzbar wäre.
Es stellt sich allerdings die Frage, ob es für uns überhaupt aussichtsreich ist, auf das Auffinden eines Todesgens zu hoffen. Bei fast allen höheren Lebewesen und mit großer Wahrscheinlichkeit auch beim Menschen existieren nämlich keinerlei Anzeichen für die Existenz wirklicher Alterungsgene, die sich quasi bei einem bestimmten Alter oder Lebensereignis einschalten oder deren Aufgabe es gar ist, Altern und Tod zu verursachen. Im ersten Teil des Buches haben wir gesehen, dass sich die Alterung beim Menschen aus vielen verschiedenen Gründen eingeschlichen hat und sehr unterschiedliche Gene daran beteiligt sind; auch pleiotrope Gene, die gleichzeitig wichtige positive Aufgaben haben. (Vgl. Abschnitt "Warum die Natur sich Altern leisten kann")
Bleibt die Frage, inwieweit der Teilungsstopp unserer Zellen als eine Art Todes- oder Alterungsbefehl wirkt. Sehen wir uns die Sache etwas genauer an.
Telomere
Damit aus einer Zelle zwei neue voll funktionstüchtige Tochterzellen entstehen können, muss der im Zellkern gespeicherte Bauplan exakt kopiert werden. Schon in den 30er-Jahren des 20. Jahrhunderts fand man heraus, dass dabei an den Informationssträngen angelagerte Endkappen eine entscheidende Rolle spielen. Der spätere Nobelpreisträger James D. Watson konnte 1972 zeigen, warum diese Endkappen, die Telomere getauft wurden, so wichtig sind. Der Kopiervorgang kann die äußersten Enden der DNA-Stränge aus technischen Gründen nicht optimal erfassen. Ein unvollständiges Ablesen aber hätte fatale Folgen für weitere Zellgenerationen.
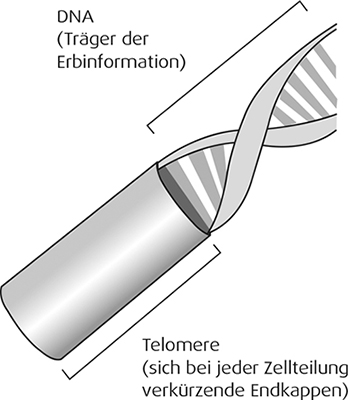
Die quasi überstehenden Endkappen (Telomere) sorgen dafür, dass die komplette DNA gelesen werden kann, allerdings dann auf Kosten der äußeren Enden dieser Telomere. Das heißt, mit jeder Zellteilung werden die Telomere kürzer. Erreicht die Telomerlänge einen kritischen Wert, muss die Zelle weitere Teilungen einstellen, wenn sie Ablesefehler vermeiden will. Das Ende ihrer Teilungsfähigkeit ist erreicht.
Telomerase – Enzym der Unsterblichkeit
Die Endstücke der Chromosomen (Informationsstränge) geben also bei jeder Zellteilung ein Stück von sich ab und ermöglichen so ein komplettes Ablesen der genetischen Information, bis sie sozusagen aufgebraucht sind. Eine gefahrlose weitere Teilung ist dann für die Zelle nicht mehr möglich.
„Stopp!“, werden Sie nun vielleicht sagen, „es gibt aber doch Einzeller wie beispielsweise Bakterien, die sich unentwegt durch Teilung fortpflanzen. Wie können diese Zellen sich wieder und wieder teilen, ohne dass die Endstücke ihrer Chromosomen irgendwann zu kurz werden?“ – Ein wirklich guter Einwand. Über Jahrzehnte vermochte ihn niemand zu beantworten.
Exakt diese Frage trieb auch Elizabeth Blackburn um, eine Biologieprofessorin der Universität von Kalifornien. Um dem Rätsel auf die Spur zu kommen, baute sie (kurz vor Weihnachten 1984) zusammen mit der erst 23 Jahre alten Studentin Carol Greider eine Art künstliche Telomere und tauchte sie in einen Extrakt aus zermahlenen Einzellern. Die junge Studentin konnte das Ergebnis kaum erwarten und so schlich sie sich noch am Weihnachtsabend ins Labor. Als sie die Zellbausteine herausnahm, hörte die Welt für einen Augenblick auf, sich zu drehen. Die Telomere waren wie von Geisterhand verlängert.
Des Rätsels Lösung lag in einem besonderen Enzym, das Einzeller in großer Menge besitzen. Es hat die Fähigkeit, die sich bei jeder Zellteilung verkürzenden Telomere wieder zu verlängern. Nur so wird das quasi ewige Leben der Einzeller ermöglicht. Die beiden Forscherinnen tauften das erstaunliche Enzym entsprechend seinen Fähigkeiten auf den Namen Telomerase.
Ein Enzym, das Zellen unendlich am Leben halten kann. Ein Baustein der Unsterblichkeit. Was für ein Fund! Wie immer dauerte es, bis die Tragweite erkannt wurde. Doch 2009 wurde Blackburn und Greider sowie dem Biologen Jack Szostak für diesen Durchbruch der Nobelpreis für Physiologie und Medizin verliehen.
Telomerase beim Menschen
Beneidenswerte Bakterien. Warum besitzt der Mensch das Enzym nicht? Tut er. Auch beim Menschen gibt es unsterbliche Zellen: Krebszellen. Zunächst wurde gemutmaßt, das Fehlen von Telomerase in den normalen Körperzellen sei ein evolutionärer Krebsschutz, doch das ist nicht der Grund. Tumorzellen entstehen nicht aus den fertig entwickelten Körperzellen, sondern in erster Linie aus ihren Vorläufern, den Stammzellen. Und diese verfügen über Telomerase (übrigens ähnlich wie die Zellen der Keimbahn, die unseren ganz individuellen Bauplan enthalten und die wir bei der Fortpflanzung weitergeben. Das ist tatsächlich eine konkrete Form der Unsterblichkeit). [Anmerkung: Heute kennen wir den Grund für die Zurückhaltung des Körpers, alle Zellen mit einem perfekten Reparaturmechanismus auszustatten. Es ist derselbe Grund, der den „behinderten“ Bakterien (wie im ersten Kapitel erwähnt) unter bestimmten Bedingungen einen Vorteil verschafft hat. Erinnern Sie sich? Es ging darum, dass alle Körperprozesse auch einen energetischen Aufwand bedeuten und so verhält es sich auch mit der Verlängerung der Telomere. Mit dem Vorhandensein des Enzyms ist es ja nicht getan. Der Prozess der stetigen Verlängerung bindet Ressourcen. Und so ist die Evolution auch hier einen Kompromiss eingegangen, einen Kompromiss zwischen dem Bestreben, den Körper jung zu erhalten, und dem Aufwand, der dafür erbracht werden muss. Die Natur könnte uns also auch über diesen Mechanismus (noch) langsamer altern lassen. Doch das wäre sehr aufwendig. Wenn wir als Individuum mehr wollen, müssen wir uns mit eigenem Aufwand selbst darum kümmern.]
Doch es sollte noch besser kommen. Weiterentwickelte Messmethoden fanden das Enzym nämlich auch in den übrigen Körperzellen, nur in weitaus geringerer Konzentration. Dennoch verrichtet es dort dieselbe Aufgabe – bloß mit entsprechend geringerem Erfolg. Und wie die weitere Forschung ergab, bleiben unsere Zellen so lange am Leben, bis der eher schwache Reparaturmechanismus den „Abnutzungsvorgängen“ nicht mehr trotzen kann. Je mehr Zellen in einem Organ irgendwann zu viele kurze Telomere haben, desto schneller altern das Organ und schließlich der ganze Organismus.
Je mehr verkürzte Telomere, desto höher ist auch das Risiko für Funktionsstörungen. Und die äußern sich dann in dem, was wir als Alterskrankheiten bezeichnen. Der Zusammenhang zwischen Krankheit und Telomerlänge wurde inzwischen für Diabetes, Herz-Kreislauf-Krankheiten, Lungenfibrose, psychische Störungen und andere Alterserscheinungen bis hin zur Gesamtsterblichkeit bestätigt. Welche Organe übrigens wie schnell altern, das hängt von der individuellen Genetik sowie von externen Faktoren ab. Und inzwischen kennen wir viele der Ursachen, die die Arbeit der wenigen Telomerase zur Sisyphusarbeit werden lassen und damit Zelltod und Störungen beschleunigen: Radikale, Fettleibigkeit, Rauchen (wobei Teer und Gase den Negativeffekt bewirken, nicht das Nikotin), nährstoffarme Ernährung, Bewegungsmangel, Stress, Vitamin-D-Mangel und noch so einiges mehr.
Doch wir brauchen uns nicht nur auf Vermeidung und Verzicht zu konzentrieren. Seitdem Telomere sehr genau vermessen werden können, hat die Forschung auch Faktoren identifiziert, mit Hilfe derer sich die Arbeit der Telomerase effektiv unterstützen lässt.
Unterstützung für Telomere
Für die folgenden Wirkstoffe wurde eine Schutzwirkung auf die Telomerlänge und damit auf die Funktionsfähigkeit und die Lebensdauer der Zellen nachgewiesen (im Tierversuch oder beim Menschen). Die Mengenangaben beziehen sich auf die Dosierung, die diesen Effekt garantiert. Teilweise sind es Dosierungen, die sich über die Ernährung erreichen lassen, teilweise ist dazu eine gezielte Nahrungsergänzung notwendig.
● Vitamin D (2000–4000 IE; Ziel sollte ein Blutspiegel von 1000 nmol bzw. 40 µg/l sein) ● Omega-3-Fettsäuren (z. B. 1000 mg Fischöl) ● Omega-6/ Omega-3-Verhältnis (– es sollte höchstens 4 zu 1 betragen; kritisch ist deshalb der heutzutage hohe Konsum von Omega-6-Fettsäuren, wie in Margarine, Distelöl, Maiskeimöl, Sonnenblumenöl) ● Kurkuma (4–10 g oder 500 µg Extrakt) ● Grüntee (500 µg Extrakt) ● Quercetin (500 mg) ● Vitamin E (100 IE und mehr; allerdings sollte sowohl Alpha-Tocopherol als auch Gamma-Tocopherol enthalten sein) ● Tocotrienole (100 mg) ● Ginkgo (125 mg Extrakt) ● TA-65 (Wirkstoff aus Astragalus; sehr effektiv, aber Dosisangabe schwierig, da Standardisierung noch uneinheitlich)Durch Kombination dieser Schutzfaktoren dürften sich synergetische Effekte ergeben, wodurch auch geringere Dosierungen optimal wirksam sind. Genaue Angaben lassen sich hier seriös nicht machen. Allerdings bestätigte eine Studie der Universität Utah 2009, dass Frauen, die ihre Ernährung mit ausreichend dosierten Multi-Nährstoffpräparaten ergänzten, tatsächlich weniger verkürzte Telomere aufwiesen.
Positiv auf die Telomerlänge wirken sich außerdem aus:
● IGF-1 bzw. das Wachstumshormon ● Estradiol (allerdings nur das körperidentische 17-beta-Estradiol)Der Stopp der Zellteilung ist nur ein Alternsfaktor
Die aufregenden Entdeckungen im Bereich der Zellteilung sollten uns nicht dazu verleiten, unsere Aufmerksamkeit ausschließlich auf diesen Aspekt zu begrenzen. Ohne Zweifel spielt die Teilungsfähigkeit unserer Körperzellen für die Alterung eine zentrale Rolle. Den Schlüssel zur Gesunderhaltung aber nur dort zu suchen, wäre zu einfach. Wenn wir sterben, haben nämlich viele Körperzellen ihre Teilungsfähigkeit noch gar nicht verloren. Auf der anderen Seite können sich Zellen mancher Organe schon früh im Leben nicht mehr teilen und bleiben dennoch lange voll funktionsfähig.
Wenn wir Abitur machen, haben unsere Gehirnzellen ihre letzte Teilung schon 20 Jahre hinter sich und funktionieren dennoch tadellos (auch wenn man bei manchen Zeitgenossen gelegentlich seine Zweifel hat). Die Zellen des Herzmuskels verlieren ebenso früh ihre Teilungsfähigkeit und verrichten dennoch, zumindest bei gesunder Lebensweise, selbst nach Jahrzehnten ununterbrochen ihre Arbeit.

„Jeden Tag ersetzt mein Körper Millionen von Hautzellen. Wie kommt es, dass die neuen genauso faltig sind wie die alten?“
Ein aufwendiger Vergleich von 2000 Krankheiten, die jeweils Phänomene vorzeitiger oder beschleunigter Alterung bei den Betroffenen auslösen, ergab, dass eine große Zahl verschiedenster Gene (etwa 7 Prozent) an Seneszenzerscheinungen beziehungsweise am Alterungsprozess beteiligt sind. Unsere Alterung wird also nicht von einer einzelnen genetischen Steuerung bestimmt. Davon können wir ausgehen. Es existiert eine ganze Reihe von Schalthebeln. Und wie sich immer deutlicher herausstellt, lassen sich viele genetische Hebel auch ohne komplizierte gentechnische Verfahren umlegen – auch in Richtung einer Verlangsamung der Alterung.
Gleiche Genetik – unterschiedliche Alterung
Um Alterungsprozesse entscheidend zu verlangsamen, sind grundlegende Veränderungen des genetischen Codes gar nicht notwendig. Der Mensch ist das beste Beispiel dafür. Im Verhältnis zu unseren genetisch bestimmten Biodaten wie Energieumsatz und Körpermasse altern wir sehr langsam. Schimpansen etwa haben zu 98 Prozent die absolut gleichen Gene wie der Mensch. Sie müssten von der genetischen Steuerung her denselben Alternsmechanismen unterliegen wie wir. Soweit wir wissen, ist das auch der Fall. Dennoch aber leben sie kaum halb so lange wie ein Mensch. Schimpansen altern im Grunde normal. Es ist der Mensch, der relativ zu seiner genetischen Ausstattung langsam altert. Das war nicht immer so.
Wir hatten schon darauf hingewiesen, dass sich die Geschwindigkeit, mit der ein Mensch altert, seit wenigstens 2000 Jahren nicht verändert hat – im Gegensatz zur extrem gestiegenen durchschnittlichen Lebenserwartung. In noch größeren Zeiträumen betrachtet, sieht das aber anders aus. Die Vorfahren des Homo sapiens lebten nicht nur durchschnittlich kürzer, auch ihre theoretische maximale Lebensspanne war geringer. Das heißt, sie waren schlechter gegen schädliche Alterungsprozesse geschützt und mussten deshalb schneller altern – trotz ihrer absolut engen genetischen Verwandtschaft mit uns. Ganz konkret in Zahlen heißt das: Der Mensch alterte im Laufe der Evolution alle 100 000 Jahre um 14 Jahre verzögert.
Wie wir unser eigenes Alternsprogramm verändern können
Wodurch konnte sich der Mensch im Verlauf seiner Entwicklungsgeschichte immer besser gegen Alterung schützen? Es ist unwahrscheinlich, dass diese unter Evolutionsgesichtspunkten „schnelle“ Entwicklung durch grundlegende Veränderungen der Gensequenz zustande kam. Wir haben heute also nicht etwa weniger oder andere „Todesgene“ als der Urmensch. Wahrscheinlicher sind sogenannte genregulatorische Prozesse, die für diese Wandlung verantwortlich sind. Was heißt das?
Gene, die in ihrer Ausprägung Altern verursachen oder besser gesagt, welche die Anfälligkeit für Alternsprozesse erhöhen, funktionieren nicht isoliert. Was von einem Gen letztlich ausgeprägt wird, hängt auch von Faktoren innerhalb und außerhalb des Körpers ab, wie beispielsweise Umwelteinflüsse, Nahrung, Verhalten und so weiter. Das Ausmaß, wie genetische Programme beeinflusst werden, erhöht sich im Laufe des Lebens sogar immer mehr.
Selbst die Zellteilung bleibt von äußeren Faktoren nicht unbeeinflusst. Obwohl es sich hier um eine eigentlich streng festgelegte Steuerung handelt, können sich Zellen zum Beispiel länger teilen, wenn sie reduziertem Sauerstoffdruck ausgesetzt sind. Viele andere Alternsprozesse innerhalb der Zellen werden dadurch verzögert. (Anmerkung: Ganz allgemein schützt ein Mehr an Sauerstoff keineswegs vor dem Altern. Im Gegenteil: Erst ein guter Schutz vor Sauerstoff verhindert das Altern – also ganz entgegen der verbreiteten Vorstellung. Wir werden auf die problematische Rolle von Sauerstoff noch öfter zurückkommen.)
Nun ist es zweifellos recht unkomfortabel, zur Verzögerung des Alterns sein Leben in einer Unterdruckkammer zu verbringen. Im Übrigen wäre das auch nicht sehr effektiv. Denn die Zahl der Zellteilungen ist eben nicht der einzige Alternsfaktor. Es gibt andere Möglichkeiten, Alternsprozesse und sogar genetische Alternsprogramme zu beeinflussen.
Kalorische Restriktion
Eine gezielte Nahrungseinschränkung (= kalorische Restriktion) gehört zu den am stärksten wirksamen Interventionen, die das Altern bremsen können. Die verschiedenen unmittelbaren Effekte auf Alternsprozesse werden wir in einem eigenen Kapitel kennenlernen (s. Kap. II.12). Die aktuelle Forschung in diesem Bereich hat inzwischen gezeigt, dass kalorische Restriktion auch direkt genetische Programmabläufe verändert. An der University of California dokumentierten Wissenschaftler jüngst, wie schnell das geschieht. Bereits wenige Wochen gezielter Nahrungsbeschränkung genügten, um die genetische Ausprägung eines älteren Organismus in die eines Jüngeren zu verändern. Das bedeutet dann, das genetische Alternsprogramm läuft auch im Alter mit der Programmierung ab, wie sie für die erste Lebenshälfte vorgesehen ist.
Hormone
Eine andere entscheidende Verbindung besteht zwischen Altern und Hormonen. Hormone sind Botenstoffe. Unter anderem transportieren sie auch die von Genen ausgehenden Alternssignale. Umgekehrt wird aber auch die Ausprägung einer Reihe von Genen von Hormonen beeinflusst. Gezielte Interventionen auf Hormonebene, wie sie heute bereits möglich sind, beeinflussen deshalb Alternsprozesse sowohl direkt als auch über ihre Rückwirkung auf Genprogramme.
Bionährstoffe
Beim Begriff „Genveränderung“ denken die Meisten sofort an Hightech-Labore. Dabei ist das Phänomen ein natürlicher Bestandteil biologischen Lebens. Zunächst einmal ist die Wahrscheinlichkeit groß, von Geburt an eine genetische Veränderung aufzuweisen. Gott sei Dank sind die Folgen der meisten „Abweichungen“ nicht dramatisch, und viele der gesundheitlich problematischeren Varianten lassen sich sogar mit relativ einfachen Mitteln korrigieren. So sind bisher allein 50 genetisch bedingte Krankheiten bekannt, die bereits durch eine erhöhte Zufuhr von Mikronährstoffen oder körpereigenen Biosubstanzen erfolgreich behandelt werden können.
Hintergrund für die therapeutische Wirksamkeit hoch dosierter Nährstofftherapien ist ein relativ neu entdecktes biologisches Phänomen: Mehr als jede dritte krank machende Genmutation reduziert die Affinität lebenswichtiger Enzyme zu ihrem Coenzym beziehungsweise Substrat. Was hier etwas kompliziert klingt, ist eine Entdeckung, die auch erhebliche Bedeutung für den Kampf gegen den Altersabbau hat – wie wir gleich sehen werden.
Die Hauptaufgabe von Vitaminen und vom Körper selbst gebildeten Biosubstanzen ist keineswegs die Vermeidung der wenigen klassischen Mangelkrankheiten. Dieses nun wirklich völlig veraltete Dogma sollten wir schnell vergessen. Vitalstoffe fungieren vielmehr als Katalysatoren unzähliger Stoffwechselreaktionen, wie unter anderem bei den enzymatisch gesteuerten Prozessen innerhalb jeder einzelnen Körperzelle. Genveränderungen führen sehr häufig zu einer Art Unempfindlichkeit lebenswichtiger Enzyme gegenüber ihren Mitarbeitern (den vitaminhaltigen Coenzymen) oder den zu verarbeitenden Werkstoffen (vitalstoffhaltige Substrate). Eine gezielte Zufuhr erhöht die unmittelbare Verfügbarkeit dieser Helfer und Substrate, wodurch die „träge“ gewordene Enzymfunktion verbessert oder sogar wiederhergestellt werden kann.
So viel zu den angeborenen genetischen Veränderungen, von denen viele, jedoch nicht alle Menschen betroffen sind. Doch gleich wird es für jeden von uns interessant: Neue Ergebnisse aus der Erforschung des zellulären Energiestoffwechsels haben einen weitreichenden Zusammenhang aufgezeigt. Veränderungen genetischer Programme mit den gerade genannten Auswirkungen auf wichtige Enzymfunktionen entstehen auch als typische Folge des Alterns. Bei jedem Menschen! Und, weil sich diese Störungen im Verlauf des Lebens immer mehr verstärken, entwickeln sie sich zu einer eigenständigen Ursache für das Altern selbst.
Vielleicht ahnen sie schon, worauf wir hinaus wollen: Wenn enzymatische Störungen aufgrund angeborener Genveränderungen mit gezielt zugeführten Vitalstoffen kompensiert werden, könnte derselbe Effekt auch bei altersbedingten Störungen der genetischen Steuerung möglich sein, soweit sie vergleichbare Enzymfunktionen betreffen. Und genau das hat sich in den vergangenen Jahren bestätigt.
Eine vermehrte Bereitstellung unterstützender Vitalstoffe kann Zellfunktionsstörungen, die aufgrund alternsbedingter Genfehler eingetreten sind, besonders Veränderungen der Mitochondrien-DNA, ausgleichen und weitere Einbußen verhindern. Wesentliche Alterungsprozesse, die für das Überleben der nicht teilbaren Zellen von Muskeln, Gehirn, des Herzens, aber auch der Zellen der Haut und anderer Organe in hohem Maße bestimmend sind, lassen sich auf diese Weise tatsächlich verhindern.
Eine Reihe dieser biologischen Substanzen sind Bestandteil zentraler Coenzyme und Substrate innerhalb der Zellen. Wie wir heute wissen, kann eine gezielte Substitution typische Altersstörungen der Enzymfunktionen beheben und darüber hinaus das Fortschreiten von Genveränderungen, Zelltod und Altern signifikant verzögern. Zu den in diesem Zusammenhang wissenschaftlich untersuchten biologischen Stoffen mit einer dokumentierten Wirksamkeit gehören:
● Carnitin (natürliche Aminosäure, unter anderem in rotem Fleisch enthalten; als Nahrungsergänzung frei verkäuflich)


